诱变育种新工具——质粒介导的大肠杆菌基因组随机高效突变技术
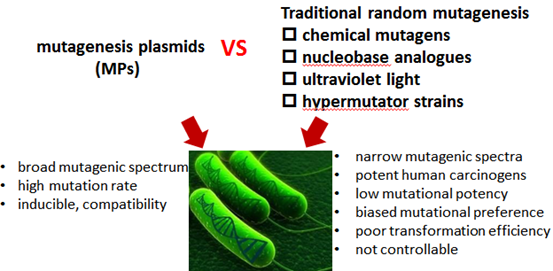
图1:MPs与传统随机诱变技术的比较
2015年10月7号Nautre communication文章Development of potent in vivo mutagenesis plasmids with broad mutational spectra在大肠杆菌中开发了一种基于质粒、可控的基因组随机高效诱变方法。
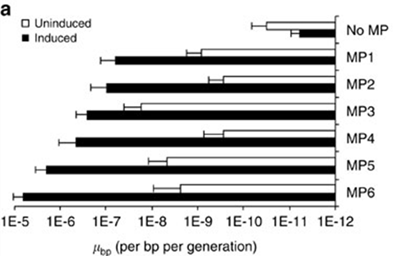
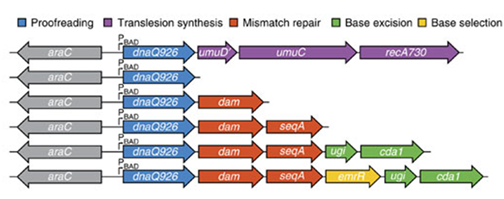
图2:MPS结构及不同MPs大肠杆菌碱基突变效率比较
该方法的原理是:诱变质粒(mutagenesis plasmids,MPs)通过阿拉伯糖启动子(PBAD)可诱导的表达干扰DNA复制过程的相关蛋白编码基因,这些编码产物可以干扰并降低DNA复制的保真性(replication fidelity),从而提高碱基在DNA复制过程中的突变率。这些影响DNA保真性的基因包括:1)DNA聚合酶III的较正结构域突变体dnaQ926,影响DNA复制的较正功能;2)DNA甲基化酶dam,可以损伤错配修复(mismatch repair);嘧啶脱氨酶cda1和尿嘧啶-DNA糖基酶抑制子ugi,干扰碱基删除修复(base-excision repair);转录抑制子emrR,干扰突变碱基的外运。MP6是同时携带这些DNA复制保真性杀手基因的诱变质粒,装载MP6后使大肠杆菌每个碱基在每一代的突变率从本底的10-9-10-10提高到6.2×10-6。
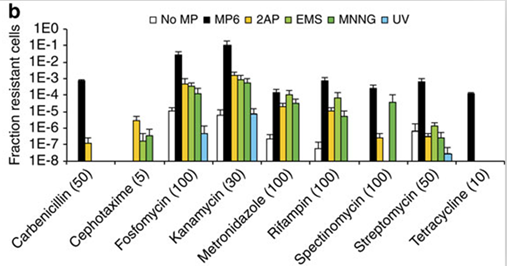
图3:MP6与传统诱变方法诱变效率的比较
作为一种新的基因组随机诱变方法,难免要与传统的随机诱变方法(化学诱变剂、紫外诱变、超级突变菌)进行比较。这里研究者选择以大肠杆菌对常用抗生素的抗性突变为指标,比较MP6与化学诱变剂甲磺酸乙酯(EMS)、甲硝基亚硝胍(MNNG)、2-氨基蝶呤(2AP),紫外线及超致变菌XL1-Blue的在诱变处理后获得抗性菌株的比例(图3)。结果,除了头孢氨噻肟(Cephotaxime)外,MP6诱变菌株中抗性菌比例是传统的化学诱变剂、紫外线和超级突变菌的1-20倍。
随后,科学家也将MP6用于噬菌体T7 RNA聚合酶随机突变,直接获得能起始T3启动子转录的突变体。
这样来看,MPs无疑是对传统诱变技术的强力改进,而作为一种质粒介导的基因组随机诱变工具,也是对现有基因组定点编辑工具(如MAGE,CRISPR-Cas)的补充。
更多生物催化内容请关注微信公众服务号:生物催化剂设计与改造服务(STS-iDeep)

(发布:)

