何爱彬研究组揭示调控器官发育与再生的表观遗传差异机制
何爱彬研究组揭示调控器官发育与再生的表观遗传差异机制
2017年5月16日,北京大学分子医学所,北京大学-清华大学生命科学联合中心研究员何爱彬研究组在《Circulation Research》杂志在线发表题为“Divergent requirements for EZH1 in heart development versus regeneration”的研究成果。该研究揭示同一表观调控因子EZH1在心脏发育和再生过程中,产生不同的组蛋白修饰,导致截然不同的分子机制,调控发育与再生两个关联的生物学过程。该结果为心脏再生的临床治疗策略提供了新的理论依据。(原文链接:http://circres.ahajournals.org/content/early/2017/05/16/CIRCRESAHA.117.311212.full.pdf?ijkey=VcziwsFRXz24DSz&keytype=ref)。
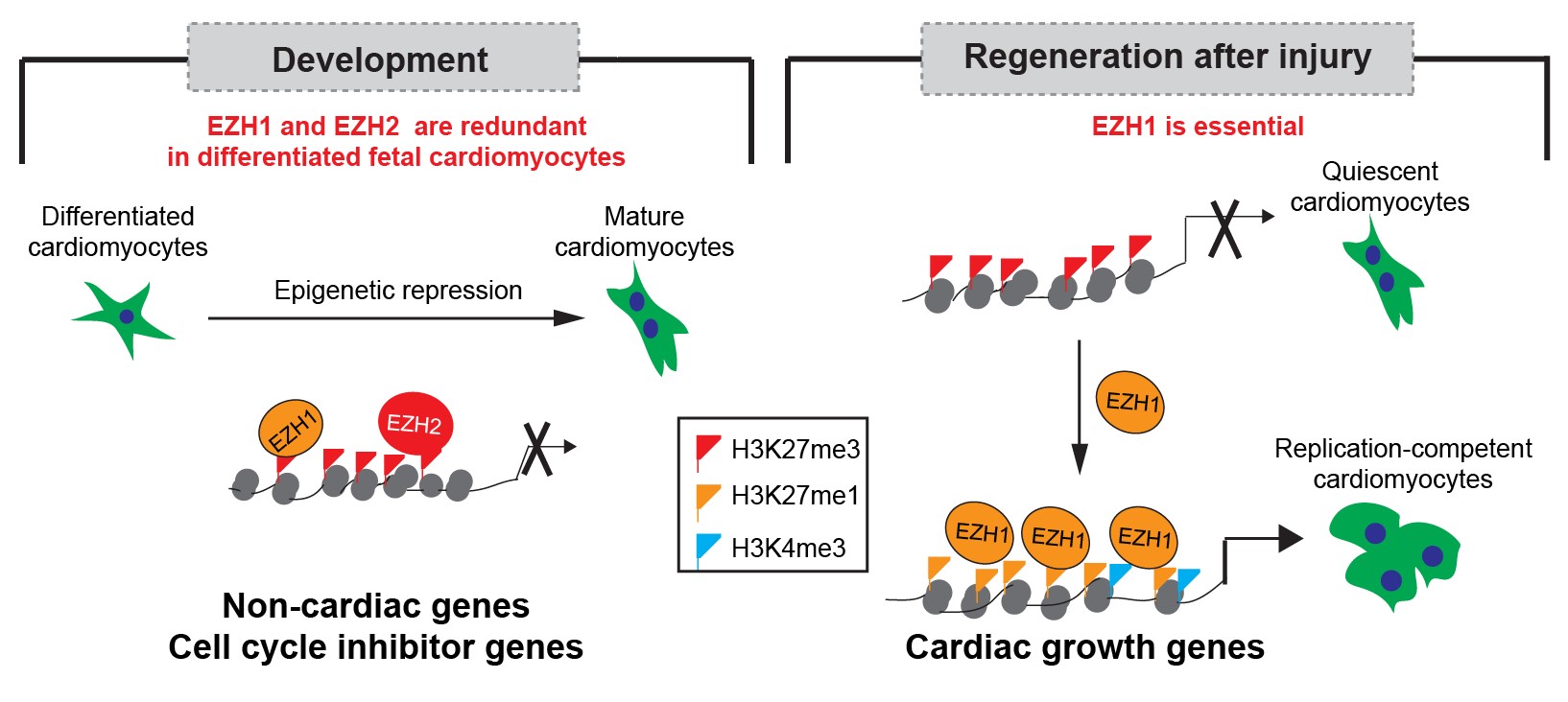
心肌梗塞是导致心衰和各种心脏疾病的主要因素,然而,成体心脏缺乏有效的再生和自我修复能力。大量心脏再生相关研究基于心脏发育调控规律的分子机制,来寻找促进心脏再生的调控分子与网络。PRC2 (Ploycomb Repressive Complex2) 是一个重要的表观遗传修饰酶复合体,它包括两个互补的催化亚基EZH1和EZH2,能修饰H3K27me3(抑制性组蛋白修饰)的形成从而抑制基因表达。我们之前发表的工作表明PRC2在心脏发育过程中起重要表观调控作用。本课题研究发现,在早期心脏发育过程中,EZH1和EZH2均通过修饰H3K27me3的形成来抑制异位基因的表达,以一种互补的方式调控心脏发育。然而在心脏再生过程中,EZH1而非EZH2起着必不可少的调控作用。转基因过表达EZH1能改善心脏疾病(心肌梗塞)后心脏的重建与功能。在这个过程中,EZH1 通过促进形成转录激活相关的组蛋白修饰(H3K27me1和H3K4me3)而激活心脏发育相关基因的表达,调控心肌细胞的增殖,促进心脏再生,改善受损心脏功能。该研究成果表明同一表观调控因子虽然在心脏发育和再生过程中均具有不可或缺的作用,但能产生不同的组蛋白修饰密码,导致截然不同的分子效应,最终却殊途同归—促进心脏形态与功能的重建与完善。
北京大学分子医学研究所2014级博士生艾珊珊,生命科学联合中心2015级博士生余先红,北京大学分子医学研究所2014级博士生李玉梅为本文的共同第一作者。分子医学研究所的何爱彬研究员为本文的通讯作者。该研究获得了北京大学-清华大学生命科学联合中心,国家自然科学基金,及青年千人计划的支持。