Protein & Cell:中科院上海生化细胞所欧阳波研究组和周界文研究
2016年3月7日,国际知名学术期刊《Protein & Cell》在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所国家蛋白质科学中心·上海欧阳波研究员和周界文研究员的一项研究成果。该研究揭示了小分子抑制剂HMA在丙型肝炎病毒离子通道p7内的结合位点,并与另一广谱性抑制剂金刚烷乙胺的结合位点进行了比较,对于研发针对p7为靶点的靶向药物分子起到关键的指导作用。 博士研究生赵琳琳为论文第一作者,欧阳波研究员和周界文研究员为论文通讯作者。
丙型肝炎病毒是目前威胁人类健康的一类顽固型病毒,可诱发肝炎、肝硬化,继而引发肝癌。迄今为止还没有研发出有效控制HCV的预防或治疗性疫苗,药物治疗的选择也很有限。因此,迫切需要进一步研究丙肝病毒生活史,以病毒基因复制、颗粒组装过程中重要蛋白为靶点,研究合适的抑制剂,寻找消灭丙肝病毒的有效途径。p7是丙肝病毒编码的唯一一个离子通道蛋白,在病毒基因复制中起到关键作用,被作为一个潜在的药物靶点得到广泛的关注和研究。相关研究表明p7可以被金刚烷乙胺、HMA等小分子抑制。但这两类分子结构上截然不同,它们与p7结合的机制是否相同?解答这一问题,将为基于结构的抗丙肝病毒理性药物设计奠定科学依据。
博士研究生赵琳琳成功纯化出状态均一、有生物活性的p7蛋白。运用甲基谱滴定的方法,比较在金刚烷乙胺、HMA滴定下蛋白质谱图的不同,发现在蛋白结构变化剧烈的顶端化学位移变化相似,但是在中间25位缬氨酸,与金刚烷乙胺不同,HMA滴定并没有明显变化。接下来,研究人员通过核极化效应方法测定了HMA在p7内的结合位点,发现与金刚烷乙胺不同,HMA结合于p7靠底部疏水区。研究人员随后与天津医科大学的王树青博士合作,通过分子动力学模拟手段,进一步精确地定位了该结合位点。研究结果表明,虽然HMA与金刚烷乙胺的结合位点不一样,但它们引起的p7构象变化类似,表明其抑制机理相似,结合位点均与疏水性相关,这将为研发以p7为靶点的新型药物分子起到一定的指导借鉴作用。
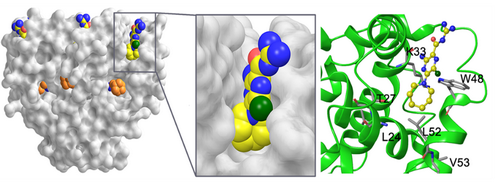
图:HMA与金刚烷胺在丙型肝炎病毒离子通道P7内的结合位点的比较
原文链接:
Structural basis of interaction between the hepatitis C virus p7 channel and its blocker hexamethylene amiloride
原文摘要:
Hepatitis C virus (HCV) infection, which causes hepatitis C and can chronically lead to serious and life-threatening diseases including liver cirrhosis and hepatocellular carcinoma (Lauer and Walker, 2001), is a rising global health problem. More than 170 million people are infected by HCV worldwide and 3–4 million people are infected each year. No effective vaccines are available to prevent HCV infection. Moreover, HCV is a fast mutating RNA virus with seven distinct genotypes and many subtypes within each genotype. The high degree of genetic diversity can lead to further viral resistance to the current therapies within individual patients (Li et al., 2012). Hence, there remains a strong desire in the medical community to explore new therapeutic opportunities.
作者:欧阳波和周界文

