EMBO Mol Med:华东师范大学刘明耀、李大力课题组等发表CRISPR/Cas9技
2016年3月10日,国际知名学术期刊《EMBO molecular Medicine》杂志在线发表了华东师范大学生命科学学院上海市调控生物学重点实验室刘明耀、李大力课题组与海南医学院附属医院马艳琳课题组等研究人员利用CRISPR/Cas9基因编辑技术定点修复成年B型血友病小鼠模型中F9基因突变,缓解凝血功能障碍的研究。研究论文题为:CRISPR/Cas9‐mediated somatic correction of a novel coagulator factor IX gene mutation ameliorates hemophilia in mouse。
研究由华东师范大学、海南医学院附属医院、上海市奉贤区中心医院以及上海邦耀生物科技有限公司合作完成,华东师范大学博士生关玉婷和海南医学院附属医院马艳琳博士为论文共同第一作者,马艳琳博士、刘明耀研究员和李大力研究员为论文共同通讯作者。
B型血友病是X染色体连锁的遗传性血液系统疾病,主要是由于编码凝血因子9(FIX)的F9基因发生突变导致凝血功能障碍。目前主要依靠不断补充外源FIX达到缓解和治疗的效果,不但费用高昂,而且与大多数遗传疾病一样无法根治。B型血友病根据FIX活性不同可以分为轻度、中度和重度三类。重症B型血友病患者体内FIX的活性低于正常人的1%,常出现严重的自发出血;中度患者FIX活性为正常人的1-5%,通常由小创伤导致出血。理论上来说只要将患者FIX活性提高到正常人的1%以上就会极大缓解病人的凝血障碍,因此血友病模型一直是基因治疗的经典模型,通过导入外源基因的方式开展了一系列临床研究,取得了重要进展。通过外源病毒导入F9 cDNA的方法存在潜在风险,是否能通过原位修复突变基因达到治疗效果还没有相关报道。
刘明耀、李大力研究组通过与海南医学院合作,在一个B型血友病家系中发现了FIX的新型Y371D突变(小鼠中对应氨基酸位点为381),通过Cas9技术构建了模拟人类突变的F9Y381D等3种具有不同凝血活性的B型血友病小鼠模型。随后,通过尾静脉注射将Cas9/sgRNA及对应的同源重组修复模板导入成年F9Y381D小鼠体内,成功地在0.56-2.84%的肝细胞中完全修复F9基因突变,显著缩短活化部分凝血活酶时间(aPTT),极大提高了断尾失血实验中F9Y381D血友病小鼠的存活率。在国际上率先证明了通过Cas9基因编辑技术原位修复F9基因突变治疗B型血友病的可行性,也为基因编辑技术应用于单基因遗传病的治疗提供了有力的实验支持。本研究从致病基因的发现,到动物模型验证,再到基因治疗,为Cas9基因编辑技术在精准医学中的应用提供了一个经典范例。该课题是刘明耀、李大力课题组在《Nature Biotechnology》和《Nucleic Acids Research》等杂志发表的一系列基因编辑相关研究的延续,为转化医学研究提供了重要参考。
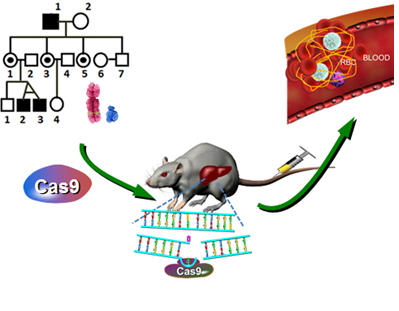
图:基因编辑技术定点修复凝血因子9突变治疗血友病
原文链接:
CRISPR/Cas9‐mediated somatic correction of a novel coagulator factor IX GENE mutation ameliorates hemophilia in mouse
原文摘要:
The X‐linked genetic bleeding disorder caused by deficiency of coagulator factor IX, hemophilia B, is a disease ideally suited for gene therapy with genome editing technology. Here, we identify a family with hemophilia B carrying a novel mutation, Y371D, in the human F9 gene. The CRISPR/Cas9 system was used to generate distinct genetically modified mouse models and confirmed that the novel Y371D mutation resulted in a more severe hemophilia B phenotype than the previously identified Y371S mutation. To develop therapeutic strategies targeting this mutation, we subsequently compared naked DNA constructs versus adenoviral vectors to deliver Cas9 components targeting the F9 Y371D mutation in adult mice. After treatment, hemophilia B mice receiving naked DNA constructs exhibited correction of over 0.56% of F9 alleles in hepatocytes, which was sufficient to restore hemostasis. In contrast, the adenoviral delivery system resulted in a higher corrective efficiency but no therapeutic effects due to severe hepatic toxicity. Our studies suggest that CRISPR/Cas‐mediated in situgenome editing could be a feasible therapeutic strategy for human hereditary diseases, although an efficient and clinically relevant delivery system is required for further clinical studies.
作者:刘明耀、李大力

