Molecular Cell:约翰霍普金斯大学在酵母实验中发现基因突变新机
Molecular Cell:约翰霍普金斯大学在酵母实验中发现基因突变新机制
这项研究结果提供了新的证据证明,基因组像一台极其复杂的机器,敲除一个很小的元件也会给整个生物体造成压力,或许会导致其他部件向别处扭曲以替代缺失的部分。
约翰霍普金斯大学Bloomberg公共卫生学院分子微生物学和免疫学教授、医学院药理学和分子科学教授J. Marie Hardwick博士说:“任何一个特定的基因缺失通常都会造成反应性的一个,或有时两个特异的基因发生‘扭曲’。将最初缺失的基因与二次突变的基因配对,给予了我们从前很大程度上未知的一个基因互作列表。”
Hardwick说,这些研究结果向研究人员提出了要求,对他们的遗传分析进行更为严格的审查,因为他们可能无意中会将一种现象归因于他们突变的基因,而实际上是由于二次突变所导致。
Hardwick说:“这项工作有可能会改变癌症遗传学领域。我们一直以来认为癌症是由抑癌基因最初突变发展形成,随后有另外一些突变帮助癌症旺盛生长。我们的研究工作提供了确凿的证据表明,这些‘另外的突变’中有一个突变或许首先出现,积极地引发了抑癌基因中看到的突变。我们希望我们在酵母中获得的研究发现将有助于确定肿瘤中的这些‘首批’突变。”
Hardwick说,利用酵母开展研究工作的优点在于,很容易敲除掉任何指定的基因。她的研究小组在工作伊始采用了现成收集的成千上万不同的酵母菌株,每个酵母菌株均敲除了一个不同的基因。
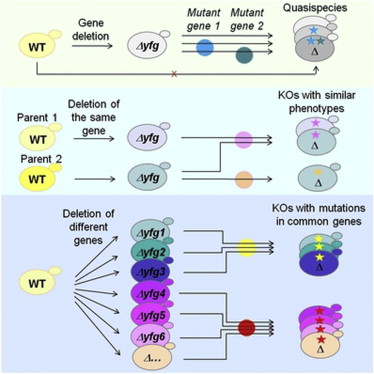
尽管这些酵母菌株每个都有一种不同的基因缺失,但在适宜的温度下均旺盛生长。Hardwick研究小组首先提出了一个基本的问题:在一个特定的酵母菌株中,每个细胞是否一如通常推测的那样,都与其他细胞具有相同的遗传序列?
Hardwick 解释说:“我们知道,例如,在一种特定的肿瘤中,不同的细胞一个基因具有不同的突变或版本。因此其他的细胞群显示相似的遗传多样性,看起来似乎是可能的。”
为了验证这一想法,她的研究小组随机选取了250个单基因突变株,每一株又产生六个亚株。然后对每一个亚株进行"压力测试"。最终科学家发现77%的突变株另外又获得了一个或两个突变。
他们随后将每个子株通过设计的一次“压力测试”以检测行为上与亲代群行为不同的子株。所有这些子株在没有压力的条件下均无差异地生长,但当温度逐渐升高数分钟时,一些子株由于无法应对压力而死亡。当Hardwick研究小组检测它们的基因时发现,除了最初敲除的基因,每个衰弱的子株都有另一个基因突变,因此研究小组得出结论,单基因敲除的每个菌株中的细胞并没有全部共享相同的遗传序列。
他们随后测试了所有5000个最初敲除单基因的菌株,寻找当给予低营养食物时能够旺盛生长(肿瘤细胞通常具有的一种性状)的子株。这是另一种压力测试,以检测来自亲代群的单个细胞之间的差异。他们鉴别了749个这样的基因敲除菌株,证实它们之间的生长差异通常是由于二次突变所导致。
总体而言,研究小组的数据表明77%的基因敲除菌株获得了另外一个或两个突变,在食物匮乏时这些突变影响了细胞生成和/或过度生长。
Hardwick认为,给酵母加压或许通过其他的方式导致生成了更高比例的双突变菌株。事实上,她说她认为“基本任何一个基因,当其突变时,都有能力去改变基因组中的其他基因。”第一个基因缺失似乎引起了生物失衡,这足以引发其他的适应性遗传变化。
此外,在所有他们检测的菌株中,他们发现出现在特定基因敲除后的二次突变总是如早期观察的那样存在于一个或两个基因中。Hardwick说,让她意外的是,子株的生长改变通常是由于二次突变而非最初的基因敲除所导致,而许多这样的二次突变都存在于已知的人类致癌基因中。
原文摘要:
Genome-wide Consequences of Deleting Any Single Gene
Xinchen Teng, Margaret Dayhoff-Brannigan, Wen-Chih Cheng, Catherine E. Gilbert, Cierra N. Sing, Nicola L. Diny, Sarah J. Wheelan, Maitreya J. Dunham, Jef D. Boeke, Fernando J. Pineda, J. Marie Hardwick
Loss or duplication of chromosome segments can lead to further genomic changes associated with cancer. However, it is not known whether only a select subset of genes is responsible for driving further changes. To determine whether perturbation of any given gene in a genome suffices to drive subsequent genetic changes, we analyzed the yeast knockout collection for secondary mutations of functional consequence. Unlike wild-type, most gene knockout strains were found to have one additional mutant gene affecting nutrient responses and/or heat-stress-induced cell death. Moreover, independent knockouts of the same gene often evolved mutations in the same secondary gene. Genome sequencing identified acquired mutations in several human tumor suppressor homologs. Thus, mutation of any single gene may cause a genomic imbalance, with consequences sufficient to drive adaptive genetic changes. This complicates genetic analyses but is a logical consequence of losing a functional unit originally acquired under pressure during evolution.

