PNAS:山东大学陈子江研究组与中科院动物所金万洙研究组联合揭
2016年2月22日,国际著名学术期刊《美国国家科学院院刊》在线发表中国科学院动物研究所研究员金万洙研究组与山东大学生殖医学研究中心教授陈子江研究组合作共同发表的一篇研究论文,研究发现通过在多囊卵巢综合征(PCOS)模型大鼠体内移植外源性棕色脂肪组织(BAT)可显著激活内源性BAT,进而改善胰岛素抵抗,恢复规律性排卵,提高受孕率。动物所博士生袁晓雪、胡涛和山东大学生殖医学研究中心研究员赵涵为论文共同第一作者,金万洙研究员、陈子江研究员为论文共同通讯作者。
多囊卵巢综合征是育龄女性常见的生殖内分泌疾病,以机体雄激素过高、月经失常、不孕等为主要症状。多囊卵巢综合征患者是2型糖尿病、肥胖、血脂异常和心血管疾病等并发症的高危人群。病因复杂,涉及机体多个系统甚至环境因素,其中胰岛素抵抗是其重要的病理生理基础。目前没有特效药能够根治失常。临床医生根据患者的症状,建议患者改变生活方式或采取针对性缓解症状等治疗方案。
金万洙研究组前期研究表明,棕色脂肪组织(BAT)移植可以抑制高脂饮食诱导的肥胖小鼠体重增加,改善肥胖小鼠的胰岛素抵抗症状,该研究已于2013年发表在Cell Research 杂志上。已有研究表明PCOS患者体内脂肪功能异常,进而出现胰岛素抵抗等代谢紊乱症状。金万洙组前期研究显示,通过PET-CT手段检测,高雄激素(DHEA)诱导的PCOS模型大鼠BAT活性显著低于正常对照组,由此他们设想能否通过增加PCOS模型大鼠体内BAT的量或激活内源性BAT来达到改善机体胰岛素抵抗进而治疗PCOS的目的。
研究组通过对PCOS模型大鼠BAT移植实验,验证了他们的猜想。BAT移植改善了大部分的PCOS症状。他们进一步研究发现,BAT分泌蛋白——脂联素(ADIponectin)在PCOS病人和模型大鼠体内含量显著低于正常对照组,通过对PCOS模型大鼠注射外源性脂联素,可获得与BAT移植类似的效果。该项研究表明,BAT可能通过脂联素有效改善PCOS症状,为今后研究治疗PCOS提供了新的思路和靶点。
鉴于在多囊卵巢综合征患者身上很难实现棕色脂肪移植手术,他们目前在规划用能够激活棕色脂肪的小分子化合物进行大规模临床实验,以达到更好的治疗多囊卵巢综合征的目的。
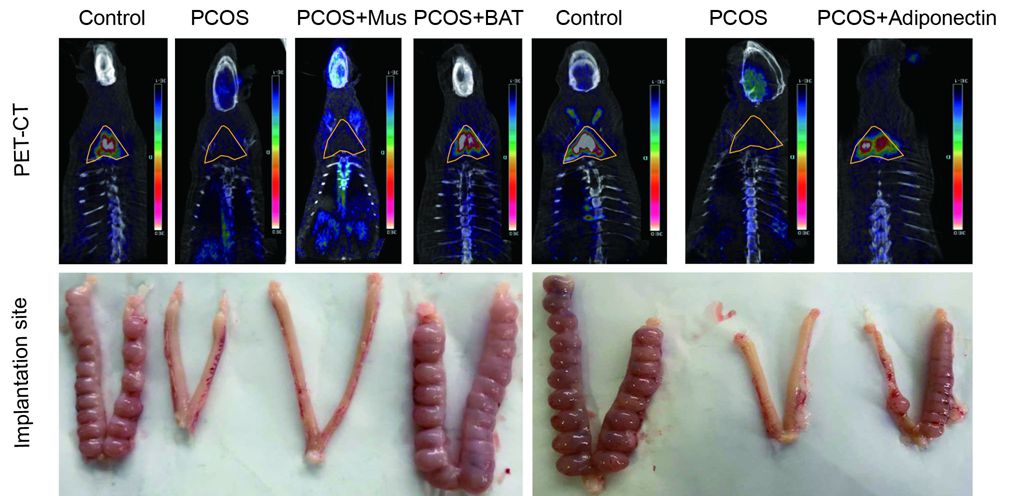
棕色脂肪移植可改善多囊卵巢综合征
原文链接:
Brown adipose tissue transplantation ameliorates polycystic ovary syndrome
原文摘要:
Polycystic ovary syndrome (PCOS), which is characterized by anovulation, hyperandrogenism, and polycystic ovaries, is a complex endocrinopathy. Because the cause of PCOS at the molecular level is largely unknown, there is no cure or specific treatment for PCOS. Here, we show that transplantation of brown adipose tissue (BAT) reversed anovulation, hyperandrogenism, and polycystic ovaries in a dehydroepiandrosterone (DHEA)-induced PCOS rat. BAT transplantation into a PCOS rat significantly stabilized menstrual irregularity and improved systemic insulin sensitivity up to a normal level, which was not shown in a sham-operated or muscle-transplanted PCOS rat. Moreover, BAT transplantation, not sham operation or muscle transplantation, surprisingly improved fertility in PCOS rats. Interestingly, BAT transplantation activated endogenous BAT and thereby increased the circulating level of adiponectin, which plays a prominent role in whole-body energy metabolism and ovarian physiology. Consistent with BAT transplantation, administration of adiponectin protein dramatically rescued DHEA-induced PCOS phenotypes. These results highlight that endogenous BAT activity is closely related to the development of PCOS phenotypes and that BAT activation might be a promising therapeutic option for the treatment of PCOS.
作者:陈子江、金万洙

