科学家首次发现大肠杆菌产生重组朊蛋白可以抑制朊病毒传播
南昌大学第一附属重症医学科医生詹以安与美国国立朊病毒疾病病理监测中心副主任、凯斯西储大学医学院副教授、南昌大学客座教授邹文泉合作完成一项研究,发现利用大肠杆菌产生的、与人类朊蛋白具有相同序列的重组蛋白,可以抑制朊病毒的传播。这有望于为治疗人类朊病毒病(俗称“疯牛病”) 提供新思路。相关文章发表于2013年10月09日的《Scientific Reports》杂志上。
科学家首次发现大肠杆菌产生重组朊蛋白可以抑制朊病毒传播
人类朊病毒疾病又称克—雅氏疾病(CJD),是一种具有传染性的致命性脑部疾病。正常朊蛋白广泛存在于人类神经中枢系统中,当该蛋白通过一个结构变化形成另一个具有传染性质的朊病毒蛋白后,它们可以继续“招募”其他正常的朊蛋白转变为朊病毒蛋白,最后导致大脑空泡化海绵样损害。目前,该病没有治愈的方法,寻找成功的干预和治疗方法十分紧迫。
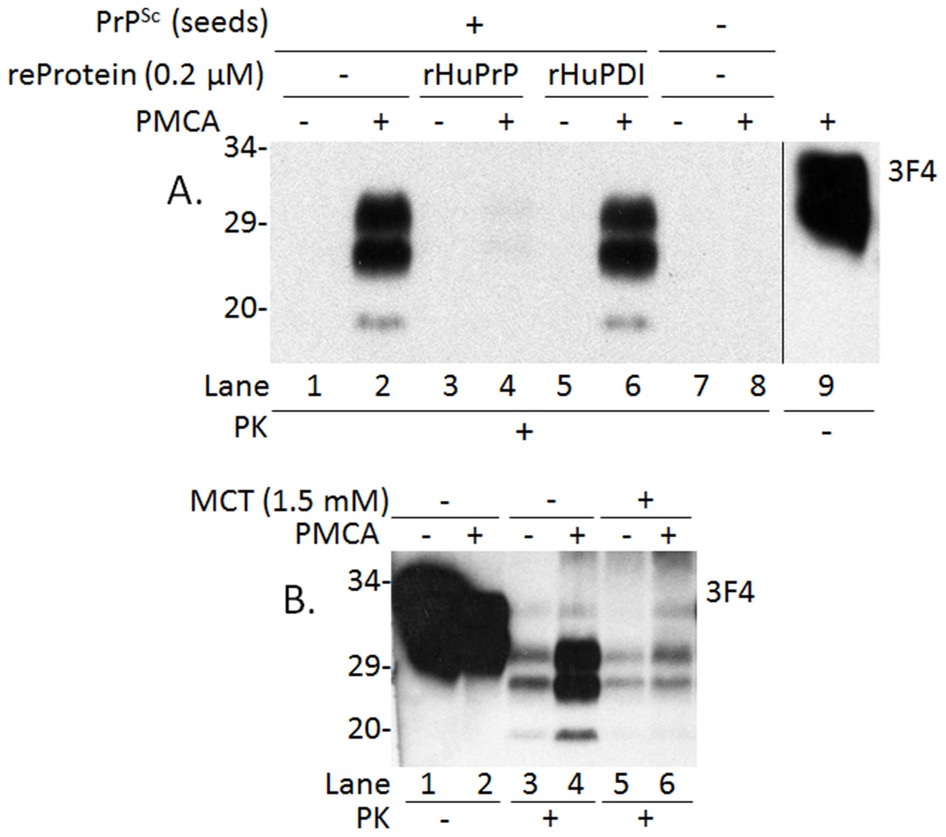
研究者使用了一种名为蛋白质错误折叠循环扩增的技术,在测试管中模拟人类大脑中朊病毒的复制过程进行了研究,当将重组蛋白加入到检测管中后,研究者发现,朊病毒的传播完全被抑制了。研究者表示,这种抑制作用的大小依赖于重组蛋白的剂量,在0.1微摩尔/升~1.0微摩尔/升的浓度下,重组蛋白对朊病毒的抑制能力最强。
邹文泉表示,该研究首次揭示重组蛋白可以阻断人类朊病毒的传播。重组的人类朊病毒蛋白是通过大肠杆菌产生的,和正常的人类大脑蛋白序列一样,因此推测其并不会有副作用。
原文摘要:
Recombinant Human Prion Protein Inhibits Prion Propagation in vitro
Jue Yuan, Yi-An Zhan, Romany Abskharon, Xiangzhu Xiao, Manuel Camacho Martinez,Xiaochen Zhou, geoff Kneale, Jacqueline Mikol, Sylvain Lehmann, Witold K. Surewicz,Joaquín Castilla, Jan Steyaert, Shulin Zhang, Qingzhong Kong, Robert B. Petersen,Alexandre Wohlkonig & Wen-Quan Zou
Prion diseases are associated with the conformational conversion of the cellular prion protein (PrPC) into the pathological scrapie isoform (PrPSc) in the brain. Both the in vivoand in vitro conversion of PrPC into PrPSc is significantly inhibited by differences in amino acid sequence between the two molecules. Using protein misfolding cyclic amplification (PMCA), we now report that the recombinant full-length human PrP (rHuPrP23-231) (that is unglycosylated and lacks the glycophosphatidylinositol anchor) is a strong inhibitor of human prion propagation. Furthermore, rHuPrP23-231 also inhibits mouse prion propagation in a scrapie-infected mouse cell line. Notably, it binds to PrPSc, but not PrPC, suggesting that the inhibitory effect of recombinant PrP results from blocking the interaction of brain PrPC with PrPSc. Our findings suggest a new avenue for treating prion diseases, in which a patient's own unglycosylated and anchorless PrP is used to inhibit PrPSc propagation without inducing immune response side effects.

