PNAS:北京大学谢晓亮、乔杰、汤富酬研究团队发表“植入前胚胎
2015年12月28日,国际著名期刊《美国国家科学院院刊》在线发表了北京大学谢晓亮、乔杰、汤富酬团队题为“Live births after simultaneous avoidance of monogenic diseases and chromosome abnormality by next-generation sequencing with linkage analyses”的最新研究成果。本研究是国际上首次建立了一种全新的植入前胚胎遗传学诊断方法MARSALA (mutated allele revealed by sequencing with aneuploidy and linkage analyses,高通量测序同时检测突变位点、染色体异常以及连锁分析),该方法可以在早期胚胎阶段对各种单基因遗传疾病和染色体疾病同时进行精确诊断,以避免严重遗传病患儿的出生。亿康基因科技有限公司参与此项研究,北大第三医院副研究员闫丽盈博士、北大生命科学学院生物动态光学成像中心副研究员黄蕾博士、博士后许丽娅为论文共同第一作者,北京大学谢晓亮教授、乔杰教授、汤富酬研究员为论文共同通讯作者,。
作为植入前胚胎遗传学诊断的新方法,MARSALA技术关键的创新点是在单细胞水平上,通过一步高通量测序即可检测致病基因突变位点和全基因组范围染色体异常,同时完成高精度连锁分析,全面提高诊断的覆盖面和精准性。
人类的每一个体细胞都含有两套遗传物质,一套来自母亲,一套来自父亲。每一套遗传物质包含30亿个碱基,分布在23条染色体上。这些碱基,包括A、T、G、C四种类型。一个细胞中的60亿个碱基遵从特定的规律排列、组合,形成每一个个体特异的遗传序列信息。
染色体数量异常将会导致染色体疾病。如每个细胞中21号染色体额外增加一个拷贝,变成三个拷贝,即会导致唐氏综合征。而60亿个碱基中任意一个碱基的改变(取代、缺失或者插入新的碱基),都可能会改变基因组中编码的遗传信息,导致机体不能正常运行,从而发生遗传疾病。
遗传疾病通常很难治愈,避免遗传患儿的出生是目前降低遗传疾病发生率的最有效途径。常规的产前诊断需要在孕12周左右进行绒毛穿刺或者在孕中期18周左右进行羊水穿刺和遗传分析,一旦确诊遗传疾病,如果选择终止妊娠,会给孕妇个人及家庭都带来巨大痛苦。基于此,植入前胚胎遗传学诊断技术应运而生。
植入前胚胎遗传学诊断(Preimplantation genetic Diagnosis, PGD)是一种在胚胎着床前就进行遗传诊断的技术。但PGD面临的最大挑战是每个胚胎能用于医学检测的细胞数量极少,通常只有1至5个细胞,以至无法对其直接进行后续的遗传分析。对这极少量的细胞的遗传物质进行数十万倍的扩增,是遗传分析必须首先解决的问题。扩增过程中出现的任何问题,如有些碱基未被扩增出来或者扩增失误等,均会导致诊断错误。
产前诊断或胚胎植入前遗传诊断要求准确性要高,假阳性率和假阴性率要低,操作步骤简单,尽量减少人为操作误差。同时,为惠及更多有需求的人群,诊断成本要尽可能降低。
目前,临床上常用的三种诊断方法在准确性、可操作性、诊断成本等方面均有其局限性。其中“原位荧光杂交方法”只能针对少数几种染色体疾病,而且受到探针来源及荧光显微镜的限制;“PCR方法”(Polymerase Chain Reaction,PCR,聚合酶链反应)只能针对单基因疾病或染色体数量的改变;“高通量芯片技术”,可进行全基因组范围的染色体检测,分辨率也显著提高,近年来应用在临床上的Karyomapping技术,能够同时检测单基因疾病及染色体异常,但无法直接对突变位点进行分析,只能间接推断。
北京大学的研究团队开展了植入前胚胎遗传学诊断新方法研究,建立了MARSALA方法,与目前常用方法相比,MARSALA方法具有以下六大突出优势:
一是精度高、分析全面。MARSALA不仅能精确诊断单基因遗传病,还能同时精准筛查染色体异常;其次,因致病突变位点序列信息可被读取至少数千次,所以结果比传统的诊断方法更加直观、可靠;
二是能够进行多重校验,大大提高诊断的精确度和可靠性。在深度解析突变位点序列信息的同时,完成高精度遗传连锁分析,提供多个SNP(Single Nucleotide Polymorphisms,单核苷酸多态性)连锁位点信息,对致病等位基因进行多重检测和反复校验,全方位降低因突变位点扩增和测序错误以及样品交叉污染等带来的问题;
三是成本大大降低。利用MARSALA进行胚胎诊断,在基因组两倍覆盖度的测序深度下(2X)就能满足所有分析需求;
四是操作方便。一步高通量测序就能得到基因突变、染色体异常以及突变位点连锁信息三个方面的精准诊断结果;
五是对各种遗传病患者家系的兼容性高。即使未生育有遗传疾病的后代,只要有试管婴儿夫妇的标本,即可进行胚胎的精确诊断;
六是适用范围广,只要预知致病基因,无论是单个基因位点的替换、缺失、插入,还是多个基因位点的复合突变,甚至是基因大片段缺失、三核苷酸重复等等,任何类型的基因突变均可采用MARSALA方法进行诊断。也就是说目前突变基因导致的已知的四千多种单基因遗传疾病都可采用MARSALA方法进行高精度的植入前遗传诊断。
该项研究详细介绍了两个诊断成功的病例。一个是常染色体显性遗传疾病,单个碱基缺失导致移码突变导致多发性骨软骨瘤,其后代无论男孩女孩均有50%患病风险;另一例是X染色体连锁的隐性遗传疾病外胚层发育不良,单个碱基发生替换突变,后代若为男孩,则有50%几率患病;后代若为女孩,50%几率会成为遗传疾病携带者。北京大学团队利用MARSALA方法对胚胎进行了遗传学诊断,对突变位点及染色体情况均进行了高精度诊断,帮助两对夫妇得到了健康的后代,目前两个婴儿都已满一岁。
技术的进步为精准医学插上了翅膀。此项研究探索、应用新的方法进行胚胎遗传学诊断,是基础与临床相结合的跨学科合作成果,也是转化医学的成果。
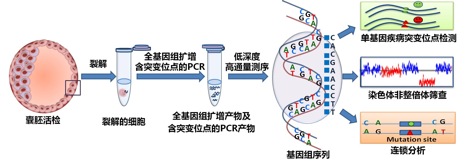
MARSALA方法示意图
原文链接:
Live births after simultaneous avoidance of monogenic diseases and chromosome abnormality by next-generation sequencing with linkage analyses
原文摘要:
In vitro fertilization (IVF), preimplantation genetic diagnosis (PGD), and preimplantation genetic screening (PGS) help patients to select embryos free of monogenic diseases and aneuploidy (chromosome abnormality). Next-generation sequencing (NGS) methods, while experiencing a rapid cost reduction, have improved the precision of PGD/PGS. However, the precision of PGD has been limited by the false-positive and false-negative single-nucleotide variations (SNVs), which are not acceptable in IVF and can be circumvented by linkage analyses, such as short tandem repeats or karyomapping. It is noteworthy that existing methods of detecting SNV/copy number variation (CNV) and linkage analysis often require separate procedures for the same embryo. Here we report an NGS-based PGD/PGS procedure that can simultaneously detect a single-gene disorder and aneuploidy and is capable of linkage analysis in a cost-effective way. This method, called “mutated allele revealed by sequencing with aneuploidy and linkage analyses” (MARSALA), involves multiple annealing and looping-based amplification cycles (MALBAC) for single-cell whole-genome amplification. Aneuploidy is determined by CNVs, whereas SNVs associated with the monogenic diseases are detected by PCR amplification of the MALBAC product. The false-positive and -negative SNVs are avoided by an NGS-based linkage analysis. Two healthy babies, free of the monogenic diseases of their parents, were born after such embryo selection. The monogenic diseases originated from a single base mutation on the autosome and the X-chromosome of the disease-carrying father and mother, respectively.
作者:谢晓亮、乔杰、汤

