生化与细胞所科研人员揭示人类致病菌白色念珠菌亮氨酰-tRNA合成酶的C-末端结构域识别tRNASer(CAG)和tRNALeu的机理
12月16日,国际学术期刊Journal of Biological Chemistry在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所王恩多研究组的最新研究成果:“C-terminal domain of leucyl-tRNA synthetase from pathogenic Candida albicans recognizes both tRNASer and tRNALeu”。
亮氨酰-tRNA合成酶(LeuRS)催化亮氨酸(Leu)与对应的亮氨酸tRNA(tRNALeu)之间的酯化反应(氨基酰化反应),生成亮氨酰-tRNA(Leu-tRNALeu),为蛋白质的生物合成提供原料。LeuRS可进一步分为细菌型和古菌/真核型。这两种类型的LeuRS都有催化结构域(负责氨基酸活化和氨基酰化)、CP1结构域(负责编校)、α-螺旋束结构域和C-末端结构域(CTD,负责结合tRNA)各一个。细菌型LeuRS和古菌LeuRS的CTD均被报道负责识别tRNALeu,但因其一级序列和三级结构不同,其识别tRNALeu的机制也不同。
在人类致病菌白色念珠菌(Candida albicans)中进化出一种嵌合的丝氨酸tRNA[CatRNASer(CAG)],该tRNASer既可以被丝氨酰tRNA合成酶(SerRS)识别生成Ser-tRNASer,又可以被LeuRS识别生成Leu-tRNASer,导致蛋白质组约97%的CUG被翻译为Ser, 3%被翻译为Leu,从而引起蛋白质组的紊乱,在白色念珠菌的表型和致病过程中产生重要影响。已有研究揭示SerRS识别CatRNASer(CAG)的机制,而LeuRS识别该tRNASer的机制尚不清楚。除CaLeuRS外,真核LeuRS(如人细胞质LeuRS和酵母LeuRS)均可识别该tRNASer,而其它类型的LeuRS(如白色念珠菌线粒体LeuRS, 嗜热古菌LeuRS和大肠杆菌LeuRS)却不能识别。真核和古菌LeuRS最大的不同在于它们CTD不同,暗示白色念珠菌的CTD对于识别CatRNASer(CAG)非常重要。
在王恩多研究员和周小龙副研究员的指导下,博士研究生纪泉泉等人发现,CaLeuRS的CTD在识别CatRNASer(CAG)和CatRNALeu中发挥至关重要的作用。截去C-末端的5个氨基酸残基(Glu1097,Val1096,Asn1095,Lys1094和Ile1093),CaLeuRS完全丧失氨基酰化活力。他们进一步鉴定出CTD中三个关键的赖氨酸残基(Lys938,Lys941和Lys1007),在亮氨酰化CatRNASer(CAG)和CatRNALeu过程中它们协同发挥重要作用;还借助凝胶迁移实验发现其两点或三点的突变都会影响酶与tRNA的结合;研究结果在酵母larS基因敲除菌株中也得到验证。该项研究扩展了人们对白色念珠菌细胞质中CTG密码子模糊性机制的研究,同时丰富了人们对于真核LeuRS识别tRNALeu机制的认识。
该项研究获得国家基础研究基金、国家自然科学基金、中科院、上海市科委等的经费资助;数据收集工作得到生化与细胞所公共技术服务中心的支持。(生化与细胞所)
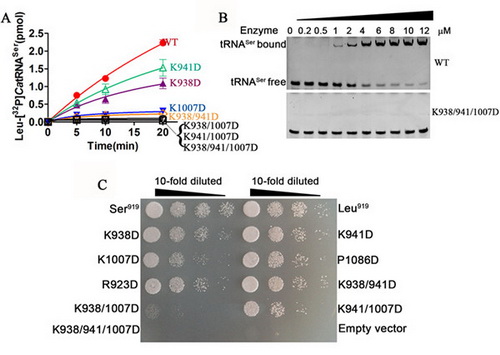
C-末端结构域3个关键赖氨酸影响酶与tRNA的结合
相关附件
