我科学家解析组蛋白氨基末端甲基化分子机制
发表日期:2015-12-02 03:20AM 阅览次数:
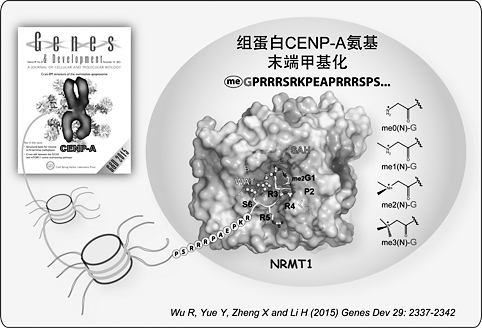
NRMT1 催化着丝粒组蛋白CENP-A 的氨基末端甲基化
日前,清华大学医学院李海涛研究组在《基因与发育》杂志发表了题为《NRMT1催化组蛋白氨基末端甲基化的分子机制》的论文,首次报道了人源氨基末端甲基转移酶NRMT1与人着丝粒组蛋白CENP-A的复合物晶体结构,并通过一系列生化实验,阐明了NRMT1识别组蛋白底物并进行氨基末端甲基化的分子机制。本工作进一步揭示了组蛋白修饰调控的复杂度和精密性。
组蛋白甲基化,通常情况下,被认为发生在赖氨酸和精氨酸残基侧链上,是一类重要的表观遗传修饰密码,在转录调控、染色质高级结构组织及DNA修复等多种过程中发挥重要功能。近年来才有报道表明哺乳动物中组蛋白甲基化也可以发生在N-末端的alpha氨基上。
李海涛研究组的工作阐明了NRMT1根据底物氨基末端前三位残基序列“Xaa-Pro-Lys/Arg”(Xaa表示为小侧链残基)选择性识别并催化底物发生氨基端甲基化的分子机理。结构分析还表明,NRMT1与其他SAM依赖的组蛋白甲基转移酶家族(SAM-MTase)成员,如DOT1L(组蛋白H3赖氨酸79甲基化转移酶)和PRMT7(一种组蛋白精氨酸甲基化转移酶)等的核心催化结构域高度相似,但与常见的SET结构域家族组蛋白甲基化转移酶差异很大。
本研究成果对于理解其他NRMT家族成员如何完成催化以及NRMT1如何催化其他蛋白底物等有着重要借鉴意义,同时也为基于结构的蛋白质改造以及后续生理功能实验提供了分子结构基础。

