Genes&Dev:清华大学施一公研究组与英国科学家联合揭示哺乳动
2015年11月6日,《Gene & Development》在线发表清华大学生命科学学院施一公教授研究组与英国MRC分子生物学实验室联合发表题为《凋亡复合体原子分辨率结构:细胞色素c和dATP激活凋亡蛋白酶活化因子1的分子机制》(Atomic structure of the apoptosome: mechanism of cytochrome c- and dATP-mediated activation of Apaf-1)的研究论文,文章揭示了哺乳动物凋亡复合体(apoptosome)的高分辨率电镜结构,并通过结构比对和生化分析揭示了细胞色素c和dATP激活Apaf-1的分子机制。清华大学生命科学学院博士生周梦萦和李旖旎为本文的共同第一作者,胡奇博士、PTN博士黄维云、闫创业博士、英国MRC分子生物学实验室的白晓辰博士为论文做出积极贡献。施一公教授与MRC的Sjors Scheres研究员为共同通讯作者。
细胞凋亡(apoptosis)又名程序性细胞死亡,在多细胞动物发育过程中扮演着重要角色,参与了形态发生(例如脊椎动物指间蹼的消失)、临时器官退化(例如男性生殖系统发育过程中,中肾旁管的消失)、以及组织形成(调控组织中不同类型细胞的数目)等许多过程。细胞凋亡在维持多细胞动物内稳态平衡中起着关键作用。凋亡被抑制是肿瘤细胞得以生长的一个重要条件,而凋亡的错误启动参与了神经退行性疾病的发生。
由于细胞凋亡和许多人类疾病相关,从上世纪90年代开始,研究人员展开了对人细胞凋亡分子机制的研究。至90年代末,已经基本描绘出该过程所涉及的信号传导通路。许多参与这些信号通路的分子成为潜在的药物靶点。对于结构生物学家来说,通过结构生物学方法解析细胞凋亡信号通路中关键蛋白的结构、研究信号传导过程中分子间的相互作用,有助于我们理解细胞凋亡的分子机理、寻找可能的成药化合物。
凋亡蛋白酶活化因子1(Apaf-1)就是参与人内源性细胞凋亡的一种关键蛋白。当细胞受到诸如DNA损伤、化学治疗药物、氧化应激等刺激时,位于线粒体内膜上的细胞色素c会被释放到胞质中,与单体形式的Apaf-1蛋白结合,引起Apaf-1构象改变,随后在ATP或dATP参与下,七个Apaf-1聚合,形成凋亡体复合体。该凋亡复合体通过激活下游的凋亡反应,最终导致细胞死亡。
为了揭示凋亡体复合体形成的分子机制,施一公实验室进行了大量系统、深入的研究。 2010年,他们在《细胞》(Cell)上发表了线虫凋亡复合体CED-4八聚体的晶体结构;2013年,他们在《基因育发育》发表论文揭示CED-4与凋亡执行蛋白酶CED-3片段的复合物结构,为理解CED-4激活CED-3的机理提供重要线索;今年2月,该实验室又在《基因与发育》发表了果蝇凋亡复合体Dark八聚体分辨率为4.0埃的电镜结构。虽然线虫和果蝇的凋亡复合体结构,能在一定程度上解释复合体的聚合由哪些相互作用介导,但是,与线虫和果蝇凋亡复合体八聚体很不相同的是,哺乳动物Apaf-1七聚体的形成还需要细胞色素c参与。细胞色素c在凋亡复合体形成中究竟发挥了什么样的作用,要解释这个问题,需要得到哺乳动物凋亡复合体的高分辨率结构。
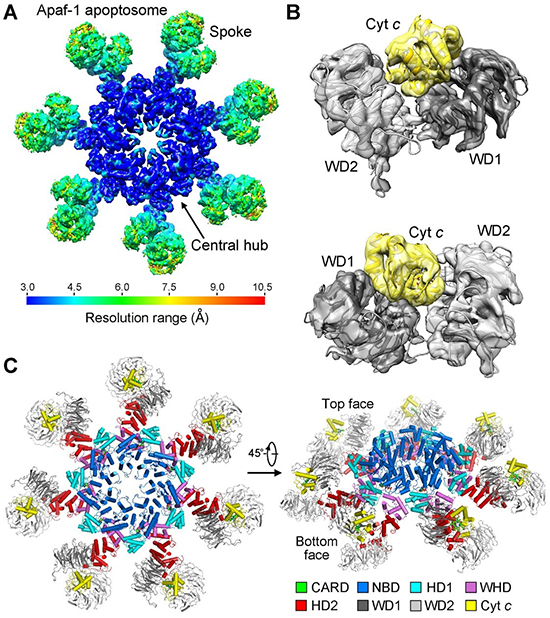
在最新的文章中,施一公研究组利用单颗粒冷冻电镜技术,重构出了分辨率为3.8埃的哺乳动物凋亡复合体三维结构。 在该结构中,七个Apaf-1分子结合在一起,呈风车状,直径约300埃。中心环状结构由NBD,HD1和WHD结构域组成,介导了七个Apaf-1的聚合。风车的最外侧,由14个WD40结构域和7个细胞色素c组成,这正是哺乳动物凋亡复合体特有的结构。放大来看,每一个细胞色素c都如三明治一般被两个WD40结构域夹在中间。该结构首次展示了细胞色素c和Apaf-1的相互作用界面,揭示出全新的由细胞色素c介导的凋亡体复合体激活机制。大量系统的生化实验验证了这种结合方式的准确性。
原文链接:
Atomic structure of the apoptosome: mechanism of cytochrome c- and datp-mediated activation of Apaf-1
原文摘要:
The apoptotic protease-activating factor 1 (Apaf-1) controls the onset of many known forms of intrinsic apoptosis in mammals. Apaf-1 exists in normal cells as an autoinhibited monomer. Upon binding to cytochrome c and dATP, Apaf-1 oligomerizes into a heptameric complex known as the apoptosome, which recruits and activates cell-killing caspases. Here we present an atomic structure of an intact mammalian apoptosome at 3.8 Å resolution, determined by single-particle, cryo-electron microscopy (cryo-EM). Structural analysis, together with structure-guided biochemical characterization, uncovered how cytochrome c releases the autoinhibition of Apaf-1 through specific interactions with the WD40 repeats. Structural comparison with autoinhibited Apaf-1 revealed how dATP binding triggers a set of conformational changes that results in the formation of the apoptosome. Together, these results constitute the molecular mechanism of cytochrome c- and dATP-mediated activation of Apaf-1.
作者:施一公

