Plant Cell:中科院植物所秦峰研究组发表植物耐旱分子机理研究进
10月27日,国际植物学《Plant Cell》期刊上在线发表中国科学院植物研究所秦峰研究组植物耐旱分子机理研究成果。秦峰研究组博士研究生丁双成和实习研究员张彬为该文的共同第一作者。
干旱是植物经常面临的一种环境胁迫,严重时会导致植物萎蔫死亡。脱落酸(ABA)作为一种“胁迫激素”,在植物受到干旱胁迫时迅速积累,对提高植物的耐旱性以及调节植物的生长发育起到重要作用。在干旱胁迫下,ABA信号能够促进植物气孔关闭,减少叶片水分散失,帮助植物抵御干旱。这个过程中,植物细胞将发生一系列的复杂反应,包括信号的感知与传递、关键蛋白的激活与降解、基因表达的变化、细胞内活性氧(ROS)含量的变化等。但是该调控过程的分子机理还有待进一步研究。
秦峰研究组发现,拟南芥中一个新的RING类泛素连接酶(E3)基因CHYR1 的表达显著受到ABA和干旱胁迫诱导。该基因主要在维管组织和气孔中表达,其蛋白在细胞核、细胞质和内质网中均有定位。研究人员对CHYR1 功能缺失突变体和功能获得植株分析发现,CHYR1 能够促进ABA诱导的气孔关闭和ROS产生,从而提高植物的耐旱性。进一步研究发现,ABA信号传递途径中的一个关键蛋白激酶SnRK2.6能够与CHYR1蛋白相互作用并磷酸化CHYR1第178位苏氨酸残基,从而增强CHYR1的泛素连接酶活性。在植物中过量表达磷酸化缺陷的CHYR1蛋白(CHYR1T178A),能够干扰体内正常的CHYR1功能,导致植物的耐旱性降低;而过量表达磷酸化状态的CHYR1蛋白(CHYR1T178D),能够促进ABA诱导ROS产生和气孔关闭,提高植物的耐旱性。
该研究发现了植物中一个新的参与干旱胁迫响应和ABA信号转导的重要调控蛋白,并阐明了其活性调节的分子机理,为更全面地认识和揭示植物响应干旱胁迫这一复杂过程的调控机理提供了新的线索。
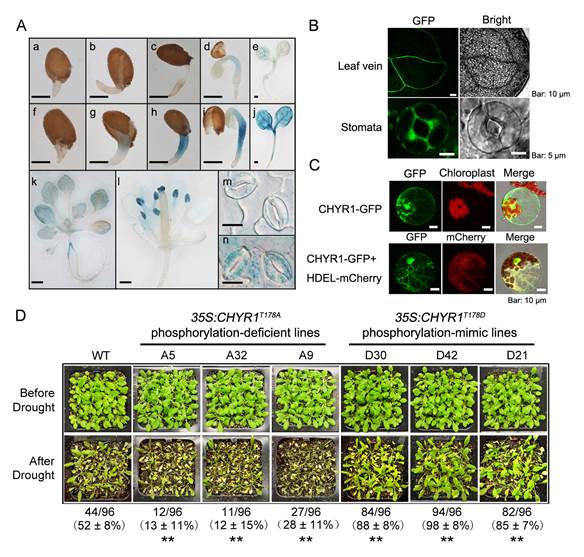
CHYR1参与调控植物对ABA信号和干旱胁迫的响应。A图.CHYR1在不同发育阶段和组织器官中的表达模式及响应ABA处理的表达模式;B图.CHYR1蛋白定位于维管组织和气孔中;C图.CHYR1的亚细胞定位;D图.过量表达磷酸化位点突变的CHYR1蛋白能够显著改变植物的耐旱性。
原文链接:
ArABIdopsis RZFP34/CHYR1, a Ubiquitin E3 Ligase, Regulates Stomatal Movement and Drought Tolerance via SnRK2.6-Mediated Phosphorylation
原文摘要:
Abscisic acid (ABA) is a phytohormone that plays a fundamental role in plant development and stress response, especially in the regulation of stomatal closure in response to water deficit stress. The signal transduction that occurs in response to ABA and drought stress is mediated by protein phosphorylation and ubiquitination. This research identified Arabidopsis thaliana RING ZINC-FINGER PROTEIN34 (RZP34; renamed here as CHY ZINC-FINGER AND RING PROTEIN1 [CHYR1]) as an ubiquitin E3 ligase. CHYR1 expression was significantly induced byABA and drought, and along with its corresponding protein, was expressed mainly in vascular tissues and stomata. Analysis of CHYR1 gain-of-function and loss-of-function plants revealed that CHYR1 promotes ABA-induced stomatal closure, reactive oxygen species production, and plant drought tolerance. Furthermore, CHYR1 interacted with SNF1-RELATED PROTEIN KINASE2 (SnRK2) kinases and could be phosphorylated by SnRK2.6 on the Thr-178 residue. Overexpression ofCHYR1T178A, a phosphorylation-deficient mutant, interfered with the proper function of CHYR1, whereas CHYR1T178D phenocopied the gain of function ofCHYR1. Thus, this study identified a RING-type ubiquitin E3 ligase that functions positively in ABA and drought responses and detailed how its ubiquitin E3 ligase activity is regulated by SnRK2.6-mediated protein phosphorylation.
作者:秦峰

