EMBO Journal:中科院上海生科院周兆才研究组揭示RIG-I-MAVS抗病毒信
2015年10月18日,国际学术期刊The EMBO Journal 在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所周兆才研究组与黄超兰研究组合作的最新研究成果——A Non-canonical Role of the p97 Complex in RIG-I Antiviral Signaling。该成果揭示了病毒RNA识别受体RIG-I被ATP酶p97及其复合物调控的新机制,为抗病毒治疗提供了新的潜在药物靶点。研究工作得到周金秋、舒红兵、蒋争凡、孙兵和王琛的大力支持,数据收集工作得到生化与细胞所公共技术服务中心、上海光源BL17U、国家蛋白质科学研究(上海)设施19U、北京同步辐射1W2B光束线站的支持与帮助。
RIG-I-MAVS介导的抗病毒免疫反应在宿主对抗病原体入侵的过程中发挥重要的作用。RIG-I识别病毒RNA,发生构象变化,其CARDs结构域被释放出来,招募TRIM25等E3泛素连接酶,催化RIG-I发生K63泛素化修饰,进而与下游接头蛋白MAVS相结合,传递抗病毒信号。病毒被清除之后,RIG-I-MAVS信号通路需要及时下调或关闭,这个过程由一系列负调控因子参与完成。
ATP酶p97及其复合物在蛋白质降解调控过程中发挥重要作用,其经典功能是将泛素化修饰的底物蛋白质从复合物或亚细胞器中抽离并运送至蛋白酶体。郝茜等在研究员周兆才的指导下,发现p97复合物能够负调控RIG-I-MAVS介导的抗病毒免疫反应,抑制I型干扰素的产生。通过解析p97复合物的三维结构,并结合生化与功能研究,证实p97复合物的正确装配及ATP酶活性对其抑制抗病毒免疫反应是必需的。进一步研究发现p97复合物在此过程中发挥非经典功能,即调控底物蛋白RIG-I的K48泛素化修饰过程,并且这一调控效果依赖于RIG-I的K63泛素化修饰。
具体而言,p97复合物类似于一个“分子桥梁”,能够同时直接结合RIG-I及其E3泛素化连接酶RNF125,从而促进RIG-I第181位赖氨酸发生K48泛素化修饰。更为重要的是,病毒侵染引起的RIG-I分子构象变化使得其CARDs结构域暴露出来并发生K63泛素化,进而可以大大增强RIG-I与p97复合物之间的相互作用。这一机制保证了抗病毒反应过程中RIG-I高效激活之后,其活性将得到实时抑制。进一步动物实验表明,利用靶向p97的小分子化合物抑制其ATP酶活性,能够促进RIG-I-MAVS信号通路激活,增强小鼠抗病毒免疫反应。这些发现均提示p97复合物是一个新的抗病毒治疗的潜在药物靶点。考虑到之前已有研究表明p97可以作为一个抗肿瘤药物靶标并研发了特异性抑制剂,而且肿瘤患者在临床上往往同时需要结合抗病毒治疗,因此针对p97复合物的药物有可能具有多重功能,开发前景值得期待。
周兆才研究组以STRIPAK超分子复合物为切入点,围绕肿瘤、感染与自身免疫等重大疾病,研究免疫反应的细胞信号机制及其病态调控,为临床诊疗、药物研发提供理论依据及候选策略。部分前期研究结果已发表于Nat Immunol (Jiao et al, 2015)、Cancer Cell (Jiao et al, 2014)、Cell Res (Zhang et al, 2014; Wang et al, 2012)、Cell Rep (Song et al, 2012)、Structure (Shi et al, 2013; Zhang et al, 2013)、JBC (Chen et al, 2014; Li et al, 2014; Zhang et al, 2015; Shi et al, 2015)等。
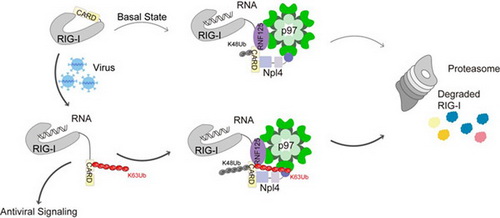
RIG-I-MAVS抗病毒信号通路调控新机制
原文链接:
A non‐canonical role of the p97 complex in RIG‐I antiviral signaling
原文摘要:
RIG‐I is a well‐studied sensor of viral RNA that plays a key role in innate immunity. p97 regulates a variety of cellular events such as protein quality control, membrane reassembly, DNA repair, and the cell cycle. Here, we report a new role for p97 with Npl4‐Ufd1 as its cofactor in reducing antiviral innate immune responses by facilitating proteasomal degradation of RIG‐I. The p97 complex is able to directly bind both non‐ubiquitinated RIG‐I and the E3 ligase RNF125, promoting K48‐linked ubiquitination of RIG‐I at residue K181. Viral infection significantly strengthens the interaction between RIG‐I and the p97 complex by a conformational change of RIG‐I that exposes the CARDs and through K63‐linked ubiquitination of these CARDs. Disruption of the p97 complex enhances RIG‐I antiviral signaling. Consistently, administration of compounds targeting p97 ATPase activity was shown to inhibit viral replication and protect mice from vesicular stomatitis virus (VSV) infection. Overall, our study uncovered a previously unrecognized role for the p97 complex in protein ubiquitination and revealed the p97 complex as a potential drug target in antiviral therapy.
作者:周兆才

