同种异体来源的CAR-T机遇与挑战
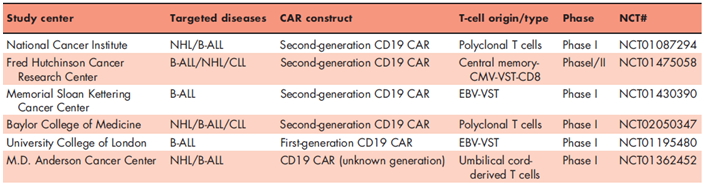
表1:目前供体来源的CAR-T细胞的临床试验
嵌合抗原受体(CARs)改造的T细胞已进入临床试验并取得了可喜的成果,应用于同种异体情况下可能存在的影响,正逐渐成为一个重要考虑因素。这篇综述讨论了在使用同种异体CAR-T细胞治疗中,CAR-T细胞上T细胞受体(TCR)信号传导可能造成的影响,以及通过敲除TCR来生产通用型制品的可能性。
最新发现
大部分关于同种异体T细胞的临床前和临床数据都侧重于关注使用的安全性,即导入CAR-T细胞的T细胞受体可能会介导移植物抗宿主病(GVHD)。近期应用于临床的供体来源的CAR-T细胞都需经过严格的病例筛选或T细胞筛选(如病毒特异性T细胞富集)。尽管没有GVHD发生的报道,但仍然需要对同种异体CAR的疗效进行优化。一些临床前试验通过记忆T细胞选择,病毒特异性T细胞,基因编辑技术或自杀基因工程技术来限制同种异体CAR介导的GVHD。
摘要
在同种异体环境中,使用供体来源的CAR-T细胞,CAR上的TCR信号传导作用可能对临床应答产生潜在的影响。更好地理解使用供体来源的T细胞治疗的作用机理对发展通用型CAR-T治疗至关重要。
关键词
过继免疫治疗,异基因造血干细胞移植,嵌合抗原受体,供体来源,移植物抗宿主病
前言
自上世纪70年代,同种异体造血干细胞移植已作为急性白血病的有效治疗手段。现在大家公认,同种异体造血干细胞移植的疗效部分依赖于从供体移植的异体细胞抗白血病作用,也被称为移植物抗白血病(GVL)效应。大部分GVL效应都是包括供体来源在内的T细胞介导的,也可以看出随后的供体T细胞输注[供体淋巴细胞输注(DLI)],可能会诱导缓解同种异体造血干细胞移植后受体体内仍然存在的或复发的造血系统恶性肿瘤。所期望的GVL效应通常被拮抗,因为同种异体T细胞会对正常组织进行攻击,被称为移植物抗宿主(GVH)反应。此外,GVL作用效力通常不能完全根除恶性肿瘤,特别是在淋巴细胞恶性肿瘤的情况下。一些方案试图加强异体造血干细胞移植的GVL效应,同时尽量降低GVH作用以减少毒性反应并提高疗效,获得了不同程度的成功。基因改造的T细胞特异性重定向恶性细胞表达的抗原,具有产生非常专一GVL响应的潜力。
第二代和第三代嵌合抗原受体(CARs),是由单克隆抗体与T细胞受体的活化区的可变区,附加T细胞共刺激信号域(即CD28, 4-1BB, Ox40)融合构建。一旦抗体与受体结合,被CARs便重定向和活化的T细胞可以作用于任何细胞表面分子,并且不受主要组织相容性复合体(MHC)限制。在近期B细胞恶性肿瘤治疗的临床试验中,抗CD19-CAR修饰的T细胞取得了很大的成功。在B细胞急性淋巴细胞白血病(ALL)中,复发性/难治性患者在接受抗CD19 CAR-T细胞治疗后,缓解率高达70-90%。接受CAR-T细胞治疗的患者大部分接受过同种异体造血干细胞移植,为接受CAR-T治疗,从供者体内采集T细胞用于CAR-T细胞制备。尽管如此,在CAR输注后没有发现移植物抗宿主病(GVHD),也许是因为移植受体已经耐受了之前采集的细胞。尽管目前同种异体造血干细胞移植接受者没有出现GVHD,接受过同种异体造血干细胞移植的患者出现的应答似乎要逊色于接受自体CAR-T细胞治疗的患者。响应的差异可能是因为化疗方案之前采集的淋巴细胞数量低或质量差,或者是在接受者体内再造的同种异体T细胞质量低下,或者两种情况都存在。供体“健康”T细胞具有的潜能是同种异体造血干细胞移植相关平台的潜在机遇。
尽管CAR-T细胞常被认为通过CAR受体具有重定向的特异性(如定向CD19),由于内源性T细胞受体的存在(TCR),也许这应该被更恰当地描述为额外的特异性。在同种异体干细胞移植下,特异于同种异体抗原(肿瘤抗原、正常抗原、病毒抗原)的T细胞的祖细胞频率具有相对较高的潜力,尤其是使用供体来源的T细胞,这些T细胞在受体体内不会产生耐受。当TCR抗原和CAR抗原都递呈给CAR-T细胞时,我们不知道哪个受体将成为主导,也不知道内源性TCR信号传导会如何影响基因改造的CAR受体的效力。此外,还可能存在旁观者效应,即同种异体反应性T细胞可能影响T细胞功能,T细胞对同种异体抗原不具有特异性但确实表达了CAR。因此,使用同种异体CAR的T细胞,特别是健康供体来源的CAR T细胞,需要对同种异体的CAR-T细胞功能有深入理解。
临床中供体来源的CARs
众所周知,人CAR-T细胞在免疫缺陷小鼠中可引起异种移植物抗宿主病。然而在临床前实验中提示,在免疫正常小鼠模型中使用供体来源的同种异体CAR-T细胞具有良好的耐受,具体表现为低GVHD发生率。目前,还没有针对GVHD的风险和供体来源的CAR-T细胞活性的临床文献报告。Kochenderfer等曾报道了一些在同种异体造血干细胞移植后使用供体来源的CD19 CAR-T细胞治疗复发性恶性血液疾病的小型样本。所有患者至少进行了1次供体淋巴细胞输注,既没有出现GVHD,或者1级急性GVHD,也没有出现慢性轻度GVHD。这个样本中在输注CD19 CAR-T细胞中没有出现GVHD,10例患者中只有3例对CAR-T细胞产生应答。值得注意的是,此项试验中患者在输注CAR-T细胞之前没有接受淋巴细胞删除性化疗,已知淋巴细胞删除性化疗在T细胞过继免疫治疗中效果显著,尽管缺乏相关数据。虽说如此,在这一小样本中,就如在输注前进行淋巴细胞删除的自体CAR治疗报道中一样,很难得出有效的结论。
第二份供体来源的同种异体CAR-T细胞治疗报告中,采用病毒特异性T细胞(VST)以降低GVHD风险。VSTs通过T细胞体外抗原刺激扩增来筛选,并用于同种异体造血干细胞移植后病毒诱发的并发症。VSTs由于携有特异于病毒抗原的内源性TCR,和额外特异于肿瘤靶点的CAR,其已成为不同CAR-T细胞(CD30, GD2, CD19等)的中坚力量。已有报道在数量有限的患者中使用供体来源的CD19 CAR VST没有发生移植物抗宿主病或细胞因子释放综合征。在此本文原创编译Paul认为,CAR-T的扩增是由于病毒感染或再激活,这表明TCR的活化能增强CAR-T细胞的扩增。然而,CAR-T细胞扩增的增强并没有使正常或恶性B细胞数量减少,这提示当内源性TCR的活化时CAR-T功能可能会受损。
目前,在clinicaltrials.gov上已有6项临床试验在对使用同种异体供体来源的CAR-T细胞进行评估(2015年6月30号,表1),以摘要的形式列出了一些初步数据。MD Anderson组进行的一项试验,对12例患者在同种异体造血干细胞移植后利用供体来源的睡美人转座子CD19 CAR进行抢占式供体淋巴细胞输注。3例均为急性淋巴细胞白血病患者全部健在并持续缓解。
使用未经处理的多克隆供体来源的T细胞和VST-CAR T细胞之间的一个区别是,基于之前同种异体特异性TCRs报道的次数,在同种异体受体体内多克隆来源的T细胞被预测遭遇TCR抗原的几率会小的多。使用VST-CAR-T细胞,在病毒感染或再激活的情况下,输注的每个T细胞都可能同时遭遇TCR或CAR抗原。使用VST-CAR-T细胞如果一个受体比另一个更有优势,那么将预示它会产生更显著的影响。与仅通过刺激CAR相比,VST-CAR T持续扩增得到增强似乎受益于通过由病毒抗原刺激TCR,但这种扩增不一定与CAR效力相关,这表明TCR的激活会产生干扰。为了更深入的了解使用同种异体CAR-T细胞欠佳结果的因素,以及在未来对这种方法进行改良,需要更好地了解在同种异体环境中T细胞的基础免疫学和CAR与TCR的相互作用。
嵌合抗原受体VS T细胞受体:异基因接受者体内的免疫生物学
T细胞表面嵌合抗原受体以及靶抗原的丰度,对于CAR-T细胞治疗功能十分重要。然而CAR 丰度因CAR结构的区别而有所不同,并且因为基因修饰的T细胞表达CAR的方法不同而差异很大,而且在大部分CAR报道中没有典型的检测体系。T细胞表面TCR丰度已被广泛研究,在单个正常CD4+T细胞表面已发现约40000个分子。研究者还发现,在表面仅有500-1000个TCR分子的CD8+T细胞能够分泌细胞因子,但低受体水平影响T细胞的效力和杀伤活性。已有报道指出CAR-T的功效依赖于CAR表达水平和靶抗原的表达水平。在第二代CD20-CAR-T细胞中发现,裂解能力的活化要求有数百靶抗原的直接结合,以及在细胞因子分泌之前有数千抗原的相互作用。在特定的T细胞表面TCR可能比CAR更多,可能导致了TCR优势。在同种异体和VST-CARs中,TCR和CAR的相互作用和动态变化有着特殊的重要性,其中有可能相当比例的T细胞同时存在两种抗原。
B-ALL:B-系急性淋巴细胞白血病;CAR:嵌合抗原受体;CLL:慢性淋巴细胞白血病; NHL:非霍奇金淋巴瘤;VST:病毒特异性T细胞。
CAR的特异性结合通常源于单克隆抗体,亲和力的显著差异以及CAR或TCR与靶细胞之间亲和力的显著差异可能存在,从而影响任意受体介导T细胞。大多数通过胸腺选择的保持着高效价的TCR具有固有的低亲和力以保证足够的“离合率”。亲和力对CAR功能的重要性知之甚少。通过抗体,部分高亲和力结合可能不允许频繁的结合和脱离,从而影响了通过CD3ζ链的信号传导。因此,T细胞可能更倾向天然的TCR信号传导,并且赋予对TCR抗原比CAR抗原更高的响应。的确,研究者对T细胞转导的激活阈值进行了研究,这类似于TCR和CAR受体在表面表达,证明了在低抗原水平下TCR比转导的CAR活性更高。事实上,在低抗原密度情况下,通过刺激TCR分泌的γ-干扰素的最大量比刺激CAR分泌的要少50%。再次,这种差异在同种异体环境中更加突出,由于TCR和CAR抗原同时存在。TCR信号的主导地位可能导致增加抗移植物宿主病并削弱CAR介导的GVL,尽管这些尚未在上述讨论的数量十分有限的接受供体来源的CAR-T细胞治疗的患者身上体现。尽管如此,TCR和CAR之间的相互作用尚未有深入的研究,而这是CAR-T细胞在临床应用中优化的关键。
通过T细胞分选来改善来自供体的CARs
如今,许多大型制药公司投资用于研究和开发CAR-T细胞的设计与生产。在理想情况下,通用的现成的产品可抵消如今临床试验进行单个细胞制剂所需成本。这些产品可能类似于正在进行的数量有限的临床试验中,同种异体造血干细胞移植后给予的供体来源的CAR-T细胞。为了能制备现成的产品,可能将要在来源于同一供体的造血干细胞移植前对这些产品进行管理。为了实现这一目标,需要有尽可能降低受体的供体细胞排斥反应和降低产品潜在的同种异体反应活性的方法。这种现成产品的安全性和有效性还待系统测试。已经提出了一些来提高同种异体供体来源的CAR-T细胞疗效的方法以用来发展通用型产品,用来提供给那些因淋巴细胞数量较低或质量较差(以及体外扩增能力低)而没有机会进行自体细胞输注的患者。
利用病毒特异性T细胞制备CAR-T的首要目标之一是筛选不含有同种异体TCR的T细胞。病毒特异性TCR的CAR制品另外一个优势是可以在CAR-T细胞过继转运后使用疫苗(如水痘带状疱疹病毒疫苗)的方法刺激天然TCR以增强T细胞的扩增。目前已有针对这一方法的自体抗GD2 CAR T细胞临床试验(NCT01953900)。
富集非同种异体T细胞另一种方法是利用抗原刺激后的记忆T细胞进行CAR转导。这可以预见到大部分记忆T细胞群很可能已经接触了异体抗原,并且T细胞携带的TCR特异于同种异体抗原将保持其天然属性。因此,记忆细胞的筛选应充实非同种异体反应库。的确,在小鼠模型中,记忆T细胞被证明更低的GVHD发生率,部分原因是由于非同种异体反应性TCR富集,以及有证据表明记忆细胞不太可能流向GVHD靶组织,如消化道。从幼稚细胞中区分记忆细胞的一个标记是CD45RA。一些临床试验选用CD45RA-CD62L+ CD8+中央记忆T细胞或CD45RA-T细胞用于CAR生产。这2种技术都显示出良好的CAR转导,体外功能和体内作用。此外,记忆CAR-T细胞能维持抗白血病能力而不引起人T细胞治疗的免疫缺陷小鼠异体移植物抗宿主这一重大的生存率限制性。目前有几项临床试验使用自体中央记忆T细胞制备的抗CD19 CAR免疫治疗非霍奇金淋巴瘤或急性淋巴细胞白血病(NCT02051257,NCT01815749,NCT02146924,NCT2153580,NCT01318317),抗IL-13Ra2治疗脑胶质瘤(NCT02208362)。一项临床试验正在对同种异体移植后使用供体来源的中央记忆CD19 CAR-T细胞进行评价(NCT 01475058,表1)
另一个用于CAR免疫治疗来源的T细胞是γδT细胞系列。这类T细胞识别抗原不同于包括通过αβTCR识别异基因抗原的蛋白质衍生肽。因此,γδT具有较低的同种异体反应性但是显示出了介导抗肿瘤反应。尽管在外周血T细胞中含量较少,一种亚型(vδ2)可在T细胞采集前使用zolendronic acid刺激在体内扩增。MD Anderson的团队使用了不同的扩增方法:在体外将γδT在表达CD19抗原递呈层上扩增后转导CD19-CAR分子。扩增的γδT在小鼠模型中证明了体内和体外有效性,尽管效力不如免疫缺陷小鼠中αβ CAR-T细胞那么引人注目。有趣的是,CAR转导来自于诱导多能干细胞的T细胞(T细胞的初始诱导)与γδT细胞基因表达很类似,表现出通用的以及CAR特异性抗肿瘤反应。尽管热情不减,但最近发现表明,分泌IL-17型γδT细胞具有潜在的肿瘤促进作用。尽管如此,高效筛选分泌IFN-γ型γδT的方法需要研究,这些T细胞将成为CAR-T细胞制备的潜在的候选者。
除了T细胞,自然杀伤(NK)细胞也可以来制备CAR用于免疫治疗。NK细胞已被证明可以显著促进GVL效果,尤其是在单倍相合MHC不匹配/KIR不匹配情况下。通常与T细胞相比,NK细胞被认为具有较低的同种异体免疫原性;然而已有NK介导GVHD的报道,在临床前研究中NK-CAR细胞已显示出对多种肿瘤抗原的疗效。使用NK-CAR的主要挑战是NK细胞免疫持久性较低,以及复杂的细胞内信号传导机制在使用常规的T细胞活化结构域时,可能会产生不兼容或不是最优情况。目前临床前研究正在评估NK细胞特定的活化域如DAP12。
利用基因编辑改进供体来源的CARs
开发供体来源的T细胞而不带有TCR活化的效果,选择性删除内源性TCR只表达特异性CAR的CAR-T细胞。在目前的基因编辑技术中,内源性TCR可以通过核酸酶,如锌指核酸酶,转录激活因子样效应物核酸酶和CRISPR/ Cas9系统来敲除。内源性TCR的缺乏消除了GVHD的可能性以及潜在的TCR受体信号干扰。利用相同的技术,供体来源的MHC I类分子可以被敲除,避免转导的现成的T细胞出现排斥反应。尽管新的基因编辑工具可以防止GVHD和排斥,重大隐患仍有待全面测试。MHC的缺失可能会引起NK对同种异体T细胞的响应。同样,已经证明含有CD3ζ域的CAR的功能取决于其内源性TCR二聚化的能力,以便与TCR/ CD3复合物的相互作用来激活的下游通路。这些研究结果表明,利用核酸酶突变内源性TCR或MHC可使CAR-T活性和持久性降低。
最后增加自杀基因对于在同种异体CAR-T细胞输注后最小化GVHD风险率十分有利。可诱导性caspase 9 (iC9)是凋亡的内在活化剂,导入同种异体T细胞,在异体造血干细胞移植后使用可有效阻断GVHD的发生。临床前模型表明,在CAR治疗中激活iC9自杀基因使CD44v6-CAR模型中异种GVHD小鼠获救。正在进行的临床试验中,已经在CAR-T细胞制品中加入了iC9构造,以消除潜在的非肿瘤相关毒性(NCT02107963,NCT01822652,NCT02439788)。
结论
CAR-T细胞是目前过继免疫治疗令人振奋的成就之一,在临床治疗ALL上取得了显著成功。目前,通常因为之前的化疗或造血干细胞移植而T细胞缺损,许多患者可能遇到疗效降低的情况。使用供体来源的细胞,尤其是现成的T细胞,需要进行评估。目前,为解决安全问题的研究很多,采用多种技术以避免出现GVHD。鲜为人知的是TCR/CAR相互作用和TCR信号转导对治疗结果的影响。在我们判定对CAR-T治疗中内源性TCR敲除是否会获益之前,对CAR和TCR的信号传导与功能进行更好的理解是必要的。总而言之,解决同种异体CAR-T的MHC匹配这一挑战,将会为使用现成的通用型CAR-T细胞铺平道路。

