生化与细胞所科研人员发明一种高效安全的新型RNAi载体
10月12日,国际学术期刊Nature Communications在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所国家蛋白质科学中心(上海)吴立刚研究组的最新研究成果“Ribozyme-enhanced single-stranded Ago2-processed interfering RNA triggers efficient gene silencing with fewer off-target effects”,该成果发明了一种较传统shRNA(short hairpin RNA)更为安全的高效RNA干扰(RNAi)载体——saiRNA。
RNAi是由siRNA介导的特异性降解具有互补序列的RNA,从而在转录后水平沉默靶基因表达的现象。RNAi在真核生物进化中高度保守,目前已被广泛应用于基因功能的研究,并可开发成为小核酸药物直接用于疾病治疗,近期已有几十种siRNA药物进入一期或二期临床试验,有望成为续小分子化合物和蛋白质(抗体)药物后的另一类新型的药物,具有很大的应用潜力。RNAi发挥基因沉默功能的核心成分是RISC复合物,主要由外源提供的siRNA与细胞内的Ago家族蛋白质组装形成。在哺乳动物中,外源siRNA主要通过两种方式获得:一种是通过化学方法直接合成双链siRNA分子,通过转染进入细胞质内与Ago蛋白结合并沉默靶基因。但化学合成siRNA的成本较高,在细胞或动物体内容易被代谢(如核酸酶)清除,作用持续时间较短,且一些类型的原代细胞难以被高效转染,因此在应用上具有一定的局限性。另一种获得siRNA的方式是通过DNA载体,利用细胞内源的RNA聚合酶Ⅲ(RNA PolⅢ),如U6、H1等的启动子驱动转录表达shRNA,转录产生的发夹状shRNA可以被细胞内源的Dicer蛋白识别并加工成siRNA,然后与Ago蛋白结合发挥作用。shRNA的表达框不仅可以构建在质粒载体上直接转染细胞进行瞬间基因沉默,还可以构建成慢病毒(lentivirus)载体,能感染大多数种类的宿主细胞并长期沉默靶基因,在高通量的功能基因筛选中有广泛的应用;如果将shRNA构建在腺病毒(ADV)和腺相关病毒(AAV)载体上,可以实现在动物整体或特定组织中沉默靶基因。
任何一种技术都要其优点和缺陷,RNAi技术也不例外。随着其广泛应用,RNAi的毒副作用逐渐被认识和报道,其来源主要包括两大类:(1)脱靶作用(off-target)。由于siRNA不仅可以通过完全互补配对的方式切割靶标RNA,还可以通过与RNA部分互补配对,以类似miRNA(microRNA)的作用方式(即2-7位seed region的碱基配对)非特异性抑制靶基因以外其它基因的表达。(2)对细胞内源miRNA的竞争抑制。由于shRNA的加工需要细胞内的Dicer、Exportin-5、Ago等蛋白质因子协助,而这些蛋白质因子也是细胞内源miRNA加工成熟所必须的。由于miRNA是细胞功能的重要调控分子,过表达的shRNA与内源miRNA竞争相同的加工机器,必然对内源miRNA的表达和功能造成抑制作用。研究标明,目前常用的传统shRNA对细胞内源miRNA具有较强的非特异性竞争抑制作用,在小鼠肝脏中长期高表达shRNA会造成严重的肝脏损伤并引发肝癌导致动物死亡。因此,如何设计一种更好的RNAi载体,在高效沉默靶基因的同时降低其毒副作用,是RNAi技术应用中亟待解决的关键科学问题。
吴立刚研究组博士研究生尚仁福等对具有不同茎环结构的siRNA前体的加工和功能进行了深入研究,并在此基础上发明了一种比传统shRNA效率更高,脱靶作用更少的新型RNAi载体。目前被广泛使用的传统shRNA 具有21bp或更长的双链区,这种设计是基于以往的研究结果:shRNA的双链区如果小于21bp就不能被细胞内的Dicer有效加工和生成siRNA。我们在研究中设计siRNA前体时,将双链区长度小于21bp的siRNA的靶向区延伸入顶端环区域,结果双链区为16-18bp的siRNA前体的加工就不再依赖于Dicer,而由RNAi的核心蛋白Ago2直接在双链区3’臂(3’ arm)的第10个碱基位置进行切割,产物被细胞内的外切核酸酶进一步在3’端切短,并最终形成长度为24-27nt的单链siRNA。我们称具有这种结构特征的siRNA前体为saiRNA(single-stranded Ago2-processed interfering RNA)。saiRNA依赖于Ago2的加工途径与细胞内一种特殊的miRNA(miR-451)的加工途径非常类似,而介于shRNA和saiRNA两种长度之间的siRNA前体既不能被Dicer,也不能被Ago2所加工,因此几乎完全没有沉默活性。进一步研究发现,saiRNA茎环结构的3’端悬垂(overhang)长度对Ago2的结合效率起决定性作用。而通常由RNA聚合酶III(polIII)转录生成的saiRNA末端有较长的3’端悬垂,无法直接被Ago2所高效识别和结合,影响了saiRNA的加工和沉默功能。因此,研究人员在saiRNA的3’末端融合了一种特殊的核酶(HDV ribozyme,丁型肝炎病毒核酶),利用该核酶的高效自切割活性,准确地在saiRNA的3’端产生两个碱基悬垂,大大提高了saiRNA前体与Ago2蛋白的结合效率,从而显著增强saiRNA对靶基因的沉默效率。
核酶增强的saiRNA相较于传统的shRNA具有以下优点:(1)脱靶作用(off-target)小。哺乳动物中Ago蛋白家族包含四个成员,但其中只有Ago2具有RNAi活性(切割完全互补配对RNA的核酸内切酶活性),而Ago1、3、4没有RNAi活性却会引起较强的脱靶作用。与传统shRNA产生的siRNA能与所有Ago蛋白结合不同,saiRNA只有与Ago2结合后才能被加工产生成熟的siRNA,因此有效避免了由Ago1、3、4介导的脱靶作用。并且其特殊的加工方式只产生一条导向链(guide strand,具有基因沉默功能的siRNA链),不会产生passenger strand(与guide strand互补配对的没有基因沉默功能的siRNA链),因此也就完全避免了由passenger strand与Ago蛋白结合后产生的脱靶作用。(2)对细胞内源miRNA的影响小。不论是化学合成的saiRNA,还是基于RNA聚合酶III的DNA表达载体在细胞内转录生成的saiRNA,其被加工后产生的siRNA的单位浓度分子对靶基因的抑制效率都高于传统的shRNA。因此,在同样的沉默效率下,saiRNA产生的成熟siRNA在细胞内的积累量要远低于shRNA,避免了占用大量Ago蛋白,并且其加工不需要Dicer等miRNA加工所必须的蛋白质因子,大大减少了对细胞内源miRNA加工和功能的竞争作用。
总之,saiRNA作为一种新型的RNAi载体,具有高效和低脱靶的特点,通过对saiRNA设计的继续优化,以及动物整体的基因沉默实验,为科学研究和基因治疗应用提供更好的工具。
本研究得到了国家科技部、国家自然科学基金委以及中国科学院的经费支持。(生化与细胞所)
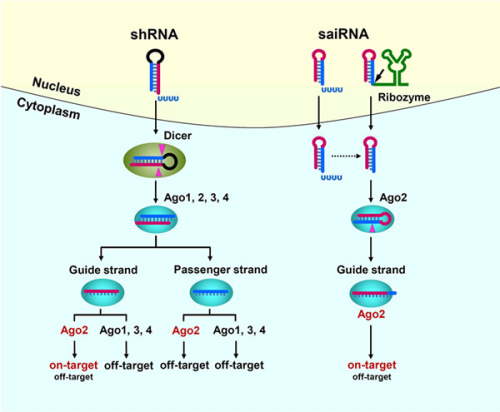
图. shRNA和saiRNA加工及作用机制示意图。shRNA转录后被细胞内的Dicer所识别加工后产生双链siRNA,其guide strand和passenger strand都能被细胞内的Ago1-4所结合,但只有Ago2才能介导与guide strand完全互补配对的靶基因RNA的切割和沉默作用(on-target),而与guide strand结合的Ago1、3、4,以及与passenger strand结合的Ago1-4都会引起脱靶作用(off-target)。saiRNA可直接被Ago2识别并加工,其特殊的加工过程避免了产生passenger strand及其脱靶作用,而且只有与Ago2结合的saiRNA才能产生guide strand去发挥on-target的作用,从而大大减少了其它Ago蛋白引起的off-target作用。saiRNA转录后通常具有较长的3’端悬垂,不能被Ago2直接识别。通过在saiRNA的3’末端融合一个自切割HDV核酶,精确产生具有2个碱基的3’端悬垂,大大促进了saiRNA与Ago2的结合效率,从而显著提高了saiRNA的沉默效率。
相关附件
