装修蓝细菌细胞工厂——安装“瑞士军刀蛋白”或能促进生物燃料合成
摘要:Plant Cell杂志最新报道美国密西根大学研究成果,研究者们在蓝细菌中构建新型“瑞士军刀蛋白”——嵌合羧酶体复合物,在结构和功能上取代了羧酶体形成所需的四个基因,有效减小多个基因表达调控的遗传压力,改造菌株可正常进行光合作用,有望用于生物燃料合成。
假设在喝咖啡之前,你需要用烤箱烘焙咖啡豆,再用研磨机碾碎,最后进行调制冲泡的话,是不是会感到困倦?在这时候,如果送你一台咖啡机,只需加入原料,便可等待香浓的咖啡,你是否会欣喜若狂?同样为了减轻蓝细菌细胞调控的压力,美国密西根大学的研究者们致力于简化羧酶体复合物的表达基因,组装最核心的蛋白结构域以保存其二氧化碳固定能力,减少所需的基因数量。最终成功在蓝细菌中构建新型“瑞士军刀蛋白”——嵌合羧酶体复合物,集合多种功能于一体,在结构和功能上取代了羧酶体形成所需的四个基因,有效减小多个基因表达调控的遗传压力,改造菌株可正常进行光合作用,有望用于生物燃料合成。这是蛋白质工程与代谢工程的完美结合,想要知道研究者们是如何装修蓝细菌的细胞工厂吗?这样的装修有什么应用前景?让我们一起走进嵌合羧酶体的构建过程:
1. 蓝细菌细胞工厂
蓝细菌生长快速、具有二氧化碳固定能力而且遗传操作相对简单,因此被认为是具有重要潜力的生物燃料合成平台。此外,蓝细菌自养生长,不依赖可发酵的糖,而且无需占用耕地面积,多年来已经在其中实现大量与生物燃料相关的化合物合成,例如乙醇、异丁醛与异丁醇。如此备受亲赖的细胞工厂,如果能进一步进行装修改造,减轻宿主细胞的代谢压力,或许能让生物燃料的合成产量更上一层楼了。
2. 什么是羧酶体
微生物的微区室是(BMCs)是指一类自我装配的结构相似、更能多样化的细胞器,在其蛋白外壳保护下,可隔绝外部的生化反应。由于BMCs功能多样化,因此在合成生物学的应用中,可作为资源丰富的代谢模块。在蓝细菌中,羧酶体是第一个被鉴定的BMC,在这个微区室中进行着碳浓缩,通过隔绝二磷酸核酮糖羧化酶与碳酸酐酶在其蛋白壳内以提高二氧化碳的固定。羧酶体可为BMCs的研究提供一个理想的测试系统,因为蓝细菌需要具有功能的羧酶体才可存活。因此,羧酶体深深地吸引了研究者们的目光。
羧酶体的自我组装过程包含了至少6个基因产物的蛋白相互作用,形成一个蛋白核心,在核心外面再形成一个蛋白外壳。这样的过程让羧酶体的调控和组装更加复杂,同时也让羧酶体(或功能多样的BMCs)转移到异源宿主的操作更具有挑战性。为了克服这样一个瓶颈,密西根大学的研究者们构建了简化的嵌合羧酶体,为蓝细菌细胞工厂创造更多的可能。
3. 嵌合羧酶体的诞生
所谓嵌合羧酶体的构建,也就如同一把瑞士军刀,让最核心的必须原件集中起来,抛弃冗余的附件,在最集中的空间集成化解决问题。羧酶体主要由两个部分构成:蛋白外壳与核心部分(图1)。研究者们通过分析蛋白结构域的相互作用,将来源于野生型羧酶体的四个组分蛋白的片段结合起来,构建了单个嵌合蛋白,简化了羧酶体的核心部分。新合成的嵌合羧酶体支持蓝细菌的正常光合做哦那个,成功缩短羧酶体形成所需的4个基因,减小细胞遗传调控与代谢压力。
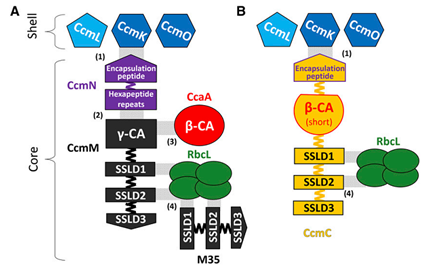
图1 野生型(A)与简化的羧酶体(B)核心结构对比
4. 嵌合羧酶体的意义与价值
细胞内的各种BMCs组成了丰富的代谢模块,羧酶体便是典型的BMC成员。相信嵌合羧酶体的成功构建能在一定程度上增加合成生物学研究者们的信心,通过蛋白结构域的相互作用可以成功获得新的BMC,当然这样的思想也可以平移到其他BMC的设计中。此外简化后羧酶体是可以一直到异源宿主中呢?其实我也十分好奇,如果将简化后的BMC植入植物细胞的话,是否可以增加二氧化碳的固定能力?减少温室效应?如果植入大肠杆菌等细菌中,加以进一步的改造后,是否可以让异养型的细菌也爱上“吃”二氧化碳呢?装修后的蓝细菌细胞工厂负荷减小了,是否能更好地合成生物燃料呢?好多好多的问号就此冒出来啦,我们将持续关注……
徐晓庶 摘译自:
http://www.plantcell.org/content/early/2015/08/28/tpc.15.00329.abstract
更多生物催化内容请关注微信公众服务号:生物催化剂设计与改造服务(STS-iDeep)
(发布:)

