逆境中心在胚系细胞特异性的CRISPR-Cas9基因修饰系统取得新进展
9月11日,国际学术期刊plant Biotechnology Journal在线发表了中科院上海植物逆境生物学研究中心朱健康研究组“Development of germ-line-specific CRISPR-Cas9 systems to improve the production of heritable gene modifications in Arabidopsis”的研究论文。该研究在模式植物拟南芥中开发出了胚系特异性的CRISPR-Cas9基因修饰系统,可以改善拟南芥中可遗传的基因修饰的发生频率和多样性。
近年来,CRISPR-Cas9系统为基因组定点修饰技术带来了革命性的飞跃,该系统已经成功应用于人类、小鼠、斑马鱼、家蚕、果蝇、酵母、拟南芥及水稻等多个物种中。这种定制化内切核酸酶系统包含两个元件:靶向识别DNA的单链向导RNA(sgRNA)及进行DNA切割的Cas9。尽管泛在性表达的CRISPR/Cas9(UC)系统可以高效地生成靶基因修饰,并且将这些基因修饰通过生殖细胞系传递给下一代,但也会伴随产生大量不可遗传的体细胞突变。因此开发和改善胚系细胞特异性的基因修饰系统,将有利于减少体细胞突变发生频率,同时极大地提高目标基因修饰的遗传率。
朱健康研究组设计并利用SPOROCYTELESS (SPL)基因的表达盒构建出了胚系特异性Cas9系统(GSC)系统,该系统可以特异地在雄性配子体中进行基因修饰。通过比较分析GSC和UC两种系统介导4个靶向內源基因位点修饰的效率和特性,发现在T1代植物中GSC系统生成的突变很少(3%),但在T2代群体中检测到大量的突变株(30%),其中70%是可以稳定遗传的杂合子;而利用UC系统生成的T2代突变群体中,大部分(70%)是嵌合体。进一步分析比较其中的两个位点显示,采用GSC系统生成的可遗传基因突变的丰度要比UC系统高37%,并且突变多态性也有显著提高。此外,研究人员还检测了另外两个基于胚系特异性启动子的CRISPR/Cas9系统(pDD45-GT和pLAT52-GT),其中pDD45-GT系统在T1代就能产生可遗传的纯合突变体。这些研究结果表明,未来对这一新的GSC系统的开发和应用将极大地推动植物中针对特定靶基因修饰类型,尤其是致死突变的大规模筛选。
该工作得到了中科院经费的支持。(逆境中心)
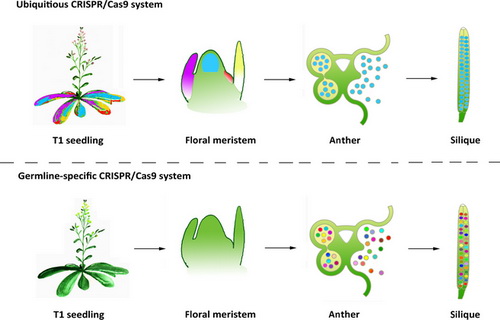
胚系特异性的CRISPR-Cas9基因修饰(GSC)系统可以提高拟南芥中可遗传的基因修饰的发生频率和多样性
相关附件
