生化与细胞所科研人员发现钙蛋白酶水解氨基酰-tRNA合成酶复合体
8月31日,国际学术期刊Journal of Biological Chemistry在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所王恩多研究组的最新研究成果,揭示了钙蛋白酶calpain参与水解多氨基酰-tRNA合成酶复合体(MSC),从而调控MSC成员的各种生物学功能。
氨基酰-tRNA合成酶(aaRS)的经典功能即催化tRNA的氨基酰化反应,合成相应氨基酰-tRNA(aa-tRNA),为蛋白质的生物合成提供重要原料。相对于原核生物中游离存在的aaRS,在真核生物aaRS能通过在生物进化中获得的附加结构域相互作用,形成多种aaRS组成的复合物,如在高等哺乳动物的细胞质中9种aaRSs和3种非酶辅因子组成的大分子复合物MSC (multiple aminoacyl-tRNA synthetase complex)。 最近的研究表明,外界刺激诱发的级联反应能迅速释放MSC中的某些成员,行使有别于经典的催化tRNA氨基酰化的非经典功能。目前研究结果表明,成员从MSC中释放主要来源于对MSC成员的磷酸化修饰。然而对MSC整体调控机制尚未见报道。因此,全面研究调控MSC的各种因素,不仅能更好地揭示aaRS参与蛋白质合成调控的分子机制,还有助于为aaRS非经典功能研究以及与aaRS相关的疾病诊断和治疗提供理论基础。
在王恩多研究员的指导下,博士研究生雷辉燕等人以亮氨酰-tRNA合成酶(LeuRS)为诱饵,通过酵母双杂交方法筛选到与其相互作用的中性钙蛋白酶calpain 2。 进一步研究发现钙蛋白酶家族成员calpain 2和calpain 1均能部分水解MSC成员,影响MSC组装,释放出多种专一的蛋白质片段,这些片段在表观上与已报道的多数aaRS功能性结构域类似。另外,通过蛋白质N-端测序,他们鉴定了精氨酰-tRNA合成酶(ArgRS)、谷氨酰氨酰-tRNA合成酶(GlnRS)以及非酶辅因子1(p43)被calpain酶切位点。经calpain调控, ArgRS, GlnRS以及p43的N-端均被水解去除,分别形成相应的截短形式ArgRSΔN63, GlnRSΔN198, p43ΔN106。通过分别比较和测定不同形式ArgRS和GlnRS的酶活性表明ArgRSΔN63拥有与野生型ArgRS相当的催化tRNA氨基酰化的效率;而 GlnRSΔN198对其底物谷氨酰胺和tRNAGln的亲合力明显降低,暗示calpain的水解调控对GlnRS依赖谷氨酰胺抗细胞凋亡的功能具有重要的影响。他们还发现p43ΔN106能在血清饥饿诱导下大量生成并分泌到胞外。进一步分析发现p43ΔN106与凋亡释放因子p43(ARF)完全一致,他们进一步在细胞水平验证了p43ΔN106在凋亡U937细胞中的形成与胞外分泌完全依赖于calpain的水解活性。以上数据均暗示,calpain在解离MSC、调控其成员的经典与非经典功能中可能具有重要的作用。
该研究工作得到了国家自然科学基金、国家基础研究基金、中国科学院和上海市科委的资助;该成果数据收集工作得到生化与细胞所公共技术服务中心的支持。(生化与细胞所)
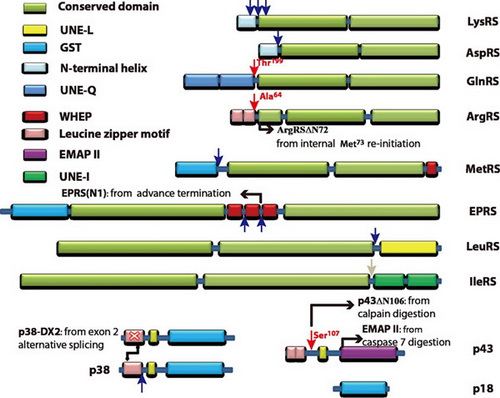
鉴定或推测钙蛋白酶calpain水解MSC成员的氨基酸区域
相关附件
