PNAS:南京大学王炜教授课题组蛋白质折叠动力学研究取得突破性
2015年8月22日在美国科学院院刊在线发表南京大学物理学院王炜教授课题组发表解决困扰学界多年的蛋白质折叠动力学突破性研究成果,该文章是关于二硫键形成与折叠关系难题方面的研究进展,论文题为“Protein folding guides disulfide bond formation”于(PNAS, 2015, DOI:10.1073/pnas.1503909112),研究工作是王炜教授课题组与马里兰大学物理科学与技术研究所Dave Thirumalai教授的合作成果,论文第一作者是物理学院秦猛副教授。
生命体功能基本是由正确折叠的蛋白质来执行,蛋白质的错误折叠不仅会使其失去原有生物学功能,也会引起一系列重大疾病,如疯牛病、老年痴呆症等。上世纪60年代,美国NIH著名科学家Anfinsen在其获诺贝尔奖工作中通过对含有二硫键蛋白质牛胰核糖核酸酶的再折叠实验研究,提出了蛋白质折叠的Anfinsen法则,即去折叠的蛋白质在体外可自发进行再折叠,决定其最终折叠结构的信息包含在蛋白质氨基酸序列之中。在含硫键蛋白质的折叠过程中,其关键环节就是二硫键的正确形成。近50年来,实验研究一直在争论到底二硫键的形成促进了蛋白质折叠,还是蛋白质折叠导致了二硫键的正确形成。正确理解二硫键形成在蛋白质折叠过程中的作用,对揭示蛋白质折叠和错误折叠的物理机制,以及寻找相关重大疾病发生的致病机理具有重要的科学意义,是相关研究领域的前沿和难点。
秦猛他们通过近年来的不懈努力,首次提出了蛋白质折叠过程中二硫键氧化和还原反应发生的物理模型,模拟了牛胰蛋白酶抑制剂(BPTI)的折叠过程,揭示了其氧化折叠的物理机制(如图1所示)。他们的结果阐明了含二硫键蛋白质的折叠动力学过程中,由序列特征所决定的构象早期形成将有效促进二硫键的形成,诠释了数十年来学界期望解决的二硫键在蛋白质折叠过程中的作用。模拟中所展示的蛋白质折叠微观动力学过程,清楚地描述了BPTI折叠早期所形成的b-发卡结构可有效促进二硫键[14-38]的形成,进而诱导其他二硫键的形成。特别是,他们还定量刻画了折叠限速中间体N*(含有2对正确折叠的二硫键5-55,14-38,如图1所示)以及最后一对正确二硫键(14-38)形成过程中所经历的非天然态二硫键中间体状态。
本工作中提出的物理模型和研究方法对探索富含二硫键蛋白质折叠提供了通用和有效的手段,是蛋白质折叠动力学和功能相关动力学研究领域的重要进展,对进一步研究蛋白质错误折叠的发生以及探讨相关重大疾病致病的分子机理提供了重要理论基础。论文网络版刊出后随即被美国科学网站phys.org专文报道“Simulation studies reveal the role disulfide bonds play in protein folding”。
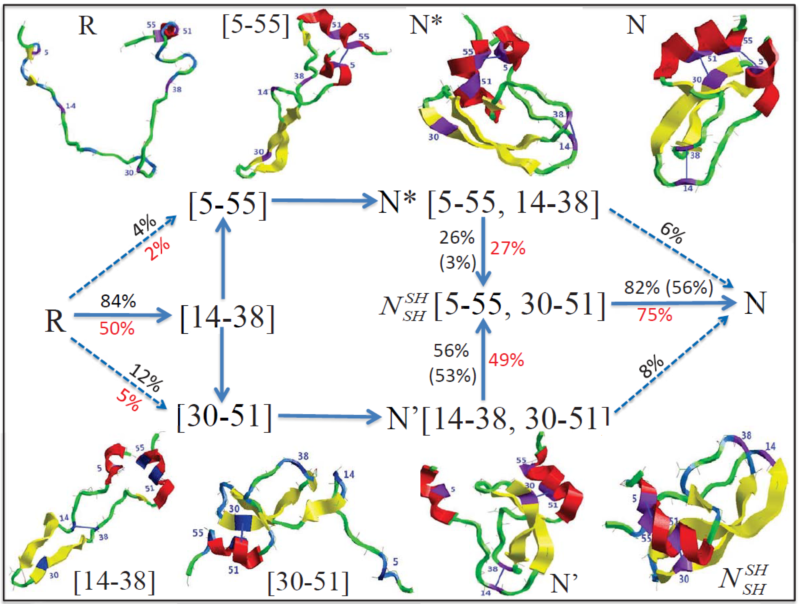
图1:蛋白质BPTI折叠路径由多个含有不同二硫键折叠中间体组成,刻画了从完全去折叠态R(二硫键全部被还原)到折叠态N(含3对正确形成的二硫键)的折叠全过程。折叠过程中所经历的关键折叠中间体、不同氧化还原环境下的折叠行为(例如通量百分比)等均被定量描述。
原文链接:
Protein folding guides disulfide bond formation
原文摘要:
The Anfinsen principle that the protein sequence uniquely determines its structure is based on experiments on oxidative refolding of a protein with disulfide bonds. The problem of how protein folding drives disulfide bond formation is poorly understood. Here, we have solved this long-standing problem by creating a general method for implementing the chemistry of disulfide bond formation and rupture in coarse-grained molecular simulations. As a case study, we investigate the oxidative folding of bovine pancreatic trypsin inhibitor (BPTI). After confirming the experimental findings that the multiple routes to the folded state contain a network of states dominated by native disulfides, we show that the entropically unfavorable native single disulfide between Cys14 and Cys38 forms only after polypeptide chain collapse and complete structuring of the central core of the protein containing an antiparallel β-sheet. Subsequent assembly, resulting in native two-disulfide bonds and the folded state, involves substantial unfolding of the protein and transient population of nonnative structures. The rate of [14–38] formation increases as the β-sheet stability increases. The flux to the native state, through a network of kinetically connected native-like intermediates, changes dramatically by altering the redox conditions. Disulfide bond formation between Cys residues not present in the native state are relevant only on the time scale of collapse of BPTI. The finding that formation of specific collapsed native-like structures guides efficient folding is applicable to a broad class of single-domain proteins, including enzyme-catalyzed disulfide proteins.
DOI:10.1073/pnas.1503909112
作者:王炜授课

