生化与细胞所科研人员揭示整合素β7在调节肠道先天免疫与肠炎中的作用及机制
7月29日,国际学术期刊Mucosal Immunology在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所陈剑峰研究组的最新研究成果“Regulatory T-cell depletion in the gut caused by integrin β7 deficiency exacerbates DSS colitis by evoking aberrant innate immunity”,揭示了整合素α4β7通过调控Treg细胞功能,抑制肠道先天免疫异常活化与肠炎的发生和发展。
炎症性肠病(Inflammatory bowel disease, IBD)是一类特殊的慢性肠道炎症性疾病,主要包括克罗恩病(CD)和溃疡性结肠炎(UC)。在IBD的发生和发展过程中,单核巨噬细胞、中性粒细胞、淋巴细胞均在肠道粘膜层异常集聚,表明先天免疫和适应性免疫在该疾病的进程中都发挥重要作用。整合素α4β7是介导免疫细胞向肠道相关免疫组织迁移的核心黏附分子,是治疗IBD的重要药靶。临床上,利用单克隆抗体vedolizumab和etrolizumab药物阻断整合素α4β7功能对IBD有明确的疗效,但高剂量抗体会导致部分病人发生不明原因的肠炎加重。
在陈剑峰研究员的指导下,博士研究生张海龙、研究人员郑雅娟等人发现在低浓度DSS处理的条件下,野生型小鼠并不会发生肠炎,而整合素β7功能缺陷小鼠会发生严重的肠炎并快速死亡。其机制为整合素β7功能缺陷导致结肠中Treg细胞显著减少,从而引发肠道上皮细胞表面黏附分子ICAM-1表达上调,进而促进巨噬细胞向结肠的迁移浸润和促炎因子的表达,最终导致先天免疫异常活化,肠道炎性反应加剧。将体外诱导的野生型小鼠Treg细胞移植到整合素β7缺失小鼠中,可以恢复肠道Treg细胞群并显著抑制DSS肠炎的发生发展。这些发现表明整合素β7在控制肠道先天免疫反应中具有重要作用。在对IBD的临床治疗中,应避免过度抑制整合素β7功能而导致肠道先天免疫反应失控而加重肠炎。该项研究对IBD临床用药有重要的指导意义,为基于整合素β7开发相关药物提供了理论指导。
本课题得到了宋保亮教授及其研究组成员的协助。该项研究工作得到国家科技部、国家自然科学基金委、中国科学院和上海市科委的经费支持。该成果数据收集工作得到生化与细胞所公共技术服务中心的支持。(生化与细胞所)
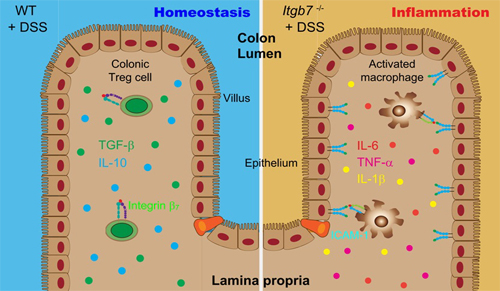
整合素β7功能缺陷抑制Treg细胞向肠道的归巢。在缺失肠道Treg的情况下,DSS处理使小鼠肠道上皮细胞ICAM-1表达上调,促进巨噬细胞向肠道的迁移浸润以及炎症因子的表达,从而加重肠炎。而移植野生型小鼠Treg细胞则可以抑制β7缺失小鼠中DSS诱导的先天免疫异常活化和肠炎的发生。
相关附件
