PNAS:清华大学饶子和教授联合国家蛋白质中心张荣光教授揭示冠
中国科学院上海生命科学研究院生物化学与细胞生物学研究所国家蛋白质科学中心•上海(筹)特聘研究员兼清华大学教授、中科院院士饶子和与国家蛋白质中心研究员张荣光领导的研究团队在新发MERS/SARS冠状病毒研究中取得新进展,首次揭示了nsp14–nsp10复合体的结构基础,阐明了冠状病毒编码校正的分子机制,该研究成果于7月9日在线发表于美国《国家科学院院刊》。
冠状病毒(CoV)是目前基因组最大的一种RNA病毒,能够感染人类引起多种急性和慢性疾病,其中最引人注目的就是sars和最近困扰韩国的MERS。
冠状病毒的庞大基因组编码了结构蛋白、非结构蛋白和一些辅助蛋白。科学家们发现,冠状病毒的非结构蛋白14(nsp14)对于病毒的复制和转录很重要。该蛋白的N端具有核糖核酸外切酶(ExoN)结构域,该结构域的校读功能可以防止基因组出现致死性突变。而nsp14的C端结构域具有甲基转移酶活性(N7-MTase),负责对病毒mRNA进行加帽。不过,人们并不了解nsp14行使这些重要功能的分子基础。
非结构蛋白10(nsp10)是能够与nsp14结合的激活子。研究人员对SARS-CoV进行研究,获得了nsp14、nsp10以及功能性配体结合时的晶体结构。这是首次揭示与RNA病毒校读有关的nsp14–nsp10复合体结构。研究人员通过结构数据和功能分析,进一步阐明了nsp14的功能,还揭示了一些可以用于药物开发的重要靶点。
在该工作中,国家蛋白质科学研究(上海)设施五线六站高通量线站(BL17B)和复合物线站(BL19U)科技人员积极参与,在实验方面提供了强有力的专业技术支持,为成果的发表做出了积极贡献。

Nsp10-nsp14复合物的结构
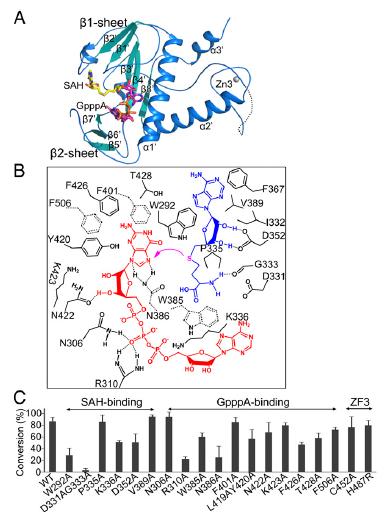
nsp14 N7-MTase domain的结构与甲基转移机制
原文链接:
Structural basis and functional analysis of the SARS coronavirus nsp14–nsp10 complex
原文摘要:
Nonstructural protein 14 (nsp14) of coronaviruses (CoV) is important for viral replication and transcription. The N-terminal exoribonuclease (ExoN) domain plays a proofreading role for prevention of lethal mutagenesis, and the C-terminal domain functions as a (guanine-N7) methyl transferase (N7-MTase) for mRNA capping. The molecular basis of both these functions is unknown. Here, we describe crystal structures of severe acute respiratory syndrome (SARS)-CoV nsp14 in complex with its activator nonstructural protein10 (nsp10) and functional ligands. One molecule of nsp10 interacts with ExoN of nsp14 to stabilize it and stimulate its activity. Although the catalytic core of nsp14 ExoN is reminiscent of proofreading exonucleases, the presence of two zinc fingers sets it apart from homologs. Mutagenesis studies indicate that both these zinc fingers are essential for the function of nsp14. We show that a DEEDh (the five catalytic amino acids) motif drives nucleotide excision. The N7-MTase domain exhibits a noncanonical MTase fold with a rare β-sheet insertion and a peripheral zinc finger. The cap-precursor guanosine-P3-adenosine-5′,5′-triphosphate and S-adenosyl methionine bind in proximity in a highly constricted pocket between two β-sheets to accomplish methyl transfer. Our studies provide the first glimpses, to our knowledge, into the architecture of the nsp14–nsp10 complex involved in RNA viral proofreading.
doi: 10.1073/pnas.1508686112
作者:饶子和、张荣光

