PNAS:清华大学杨茂君课题组揭示一种ABC氨基酸转运蛋白的底物选
2015年4月7日,清华大学杨茂君教授研究组在《美国科学院院刊》(《PNAS》)在线发表了名为《Structural basis for substrate specificity of an amino acid ABC transporter》的科研论文,首次报道了一种氨基酸底物结合状态下的ABC转运蛋白复合物的晶体结构,对其功能特性和底物选择性机制进行了研究,为更好的理解ABC转运蛋白如何选择与转运底物提供了重要的线索。
ABC转运蛋白(ATP-binding cassette transporter)作为最大的跨膜物质转运蛋白超家族之一,广泛存在于所有真核和原核生物中,它们利用水解ATP产生的能量,完成对小到各种离子大到蛋白的各种各样物质的转运。根据转运方向的不同,ABC转运蛋白可以分为importer和exporter两大类。在细菌等原核生物中,ABC转运蛋白主要位于细胞质膜上介导糖类、氨基酸、磷脂和多肽的转运;在哺乳动物等高级生物中,ABC转运蛋白在肠道、血脑屏障以及胎盘中广泛分布,可以介导磷脂、亲脂性药物、胆固醇和其他小分子的转运,在体内正常物质运输以及排出外源有毒物质和代谢废物的过程中发挥重要作用。ABC转运蛋白基因发生突变后会导致多种疾病,包括肾上腺脑白质营养不良、囊胞性纤维症、视网膜变形、血胆脂醇过多以及胆汁阻塞等等。
长久以来,对于ABC转运蛋白的研究主要集中于其转运机制的研究,即ABC转运蛋白是如何利用水解ATP的能量来完成构象变化,进而来完成对底物的转运。而对于ABC转运蛋白的底物选择性的机理仍不清楚。杨茂君课题组解析了腾冲嗜热菌中的一种氨基酸ABC转运蛋白Art(QN)2及其结合蛋白ArtI的晶体结构,同时解析了Art(QN)2与不同底物以及ATP结合状态下的晶体结构,首次鉴定了ABC importer中跨膜区结构域(TMD)同时存在着两个底物结合位点(图)。序列分析表明,这一特点很可能是同源二聚体形式的ABC importer的共同特点。功能试验表明,这些跨膜区底物结合位点关键氨基酸残基的突变对于ArtI- Art(QN)2 复合物的ATPase的活性有着显著影响。这些研究初步揭示了ABC importer同时选择和转运两个底物的可能的分子机制(图)。
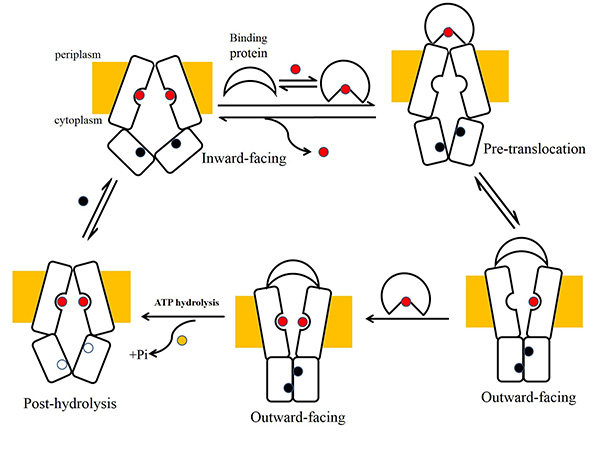
图:ABC复合物同时转运两个底物的分子机制
清华大学生命学院在读博士生于杰和盖景鹏同学为本文的共同第一作者,杨茂君教授为本文的通讯作者。德国洪堡大学的Johanna Heuveling博士和Erwin Schneider教授也参与了本文的部分研究。上海同步辐射及凤凰工程基础设施为晶体数据收集提供了及时有效的支持。本项目受到清华-北大生命联合中心、国家自然科学基金委及科技部重大研究计划的支持。
Structural basis for substrate specificity of an amino acid ABC transporter
ATP-binding cassette (ABC) transporters are ubiquitous integral membrane proteins that translocate a variety of substrates, ranging from ions to macromolecules, either out of or into the cytosol (hence defined as importers or exporters, respectively). It has been demonstrated that ABC exporters and importers function through a common mechanism involving conformational switches between inward-facing and outward-facing states; however, the mechanism underlying their functions, particularly substrate recognition, remains elusive. Here we report the structures of an amino acid ABC importer Art(QN)2 from Thermoanaerobacter tengcongensis composed of homodimers each of the transmembrane domain ArtQ and the nucleotide-binding domain ArtN, either in its apo form or in complex with substrates (Arg, His) and/or ATPs. The structures reveal that the straddling of the TMDs around the twofold axis forms a substrate translocation pathway across the membrane. Interestingly, each TMD has a negatively charged pocket that together create a negatively charged internal tunnel allowing amino acids carrying positively charged groups to pass through. Our structural and functional studies provide a better understanding of how ABC transporters select and translocate their substrates.
Doi:10.1073/PNAS.1415037112/-/DCSupplemental
作者:西瓜

