微生物所解析细菌“智商”复杂性研究取得新进展
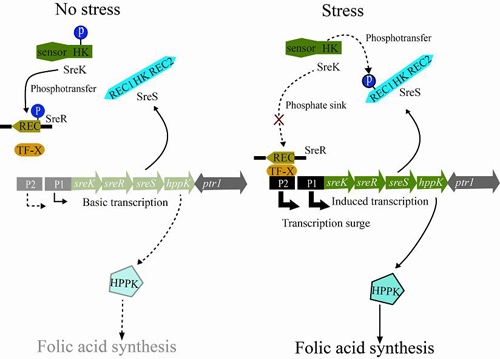
生物遭受外界环境刺激后,相关基因往往会发生表达水平的适应性变化,以维持正常的生命活动。然而,诱导表达并非只是简单的“开-关”过程,其动力学特征和调控机制非常复杂。其中,脉冲式表达(surge)模式普遍存在于病原菌毒力因子表达、动物激素的产生和癌症发展过程中肿瘤坏死因子的表达等重要生理生化过程中。针对脉冲式表达的过程及精细调控分子机制的研究还十分匮乏。
双组分信号转导系统是细菌细胞最重要的感应外界环境刺激的分子机制,曾被国内外研究者形象地比喻为细菌的“神经系统”。细菌细胞一般编码数个到数百个双组分信号转导系统蛋白,其数量多少直接反映了不同细菌“智商(IQ)”的高低(Galperin,2005.BMCMicrobiology)。该信号系统由组氨酸激酶和反应调节蛋白两部分组成,通过蛋白质磷酸化修饰完成信号的跨膜传递。
野油菜黄单胞菌(Xanthomonascampestrispv.campestris)基因组一共编码106个双组分信号系统蛋白,是一种“IQ”非常高的植物病原细菌。在对该细菌的双组分信号系统进行比较与功能基因组分析的基础上,中科院微生物研究所的研究人员鉴定到一个结构独特的组氨酸激酶SreS。SreS除了具有组氨酸激酶的保守蛋白结构外,还编码2个类似反应调节蛋白的结构,是一种杂合性质的组氨酸激酶。有意思的是,在细菌受到高盐胁迫的过程中,SreS并不发挥激酶的功能去直接磷酸化另外一个反应调节蛋白SreR,而是作为SreR的竞争者(phosphatesink),利用其复杂结构中的一个反应调节蛋白部件(REC1)从SreR的伙伴激酶SreK处将磷酸基因竞争过来,导致SreK-SreR双组分信号转导系统的蛋白质磷酸化过程受阻,造成SreR的脱磷酸化。SreS,SreK,SreR和参与叶酸代谢的蛋白HPPK由同一个操纵子编码,受到2个启动子元件的协同控制。SreR脱磷酸化后会激活其中的一个启动子,使基因的表达水平在胁迫诱导基础上发生一次“跃迁”,从而表现出脉冲式的表达模式。研究者同时还证明,如果这一脉冲式的表达受到干扰,细菌抵抗胁迫的能力严重下降。因此,上述调控过程是细菌细胞应对外界环境刺激的重要分子机制之一。由SreS、SreK和SreR构成的“三组分信号转导系统”比“双组分信号转导系统”更加复杂,有利于细菌通过更多的途径与方式对自身生理活动进行精细调节。
双组分信号转导系统的结构、调控功能与进化是微生物所钱韦课题组的主攻研究方向之一。本研究主要由该组2010级博士研究生王芳芳完成,曾获得国家自然科学基金等项目的资助,目前已在线发表于微生物学领域国际期刊EnvironmentalMicrobiology。

