Nature:新开发催化剂能滑动并定点修饰DNA
日前,来自荷兰阿纳姆-内梅亨大学的研究人员发现,通过人工合成的方式修饰一种天然催化剂,能结合到 DNA ,在其上进行滑动并在特定位点裂解 DNA。这一发现将有助选择性修饰诸如 DNA 之类的聚合物。相关成果发表在2013年9月22日的《Nature》上。
催化剂,能结合到 DNA ,在其上进行滑动并在特定位点裂解 DNA
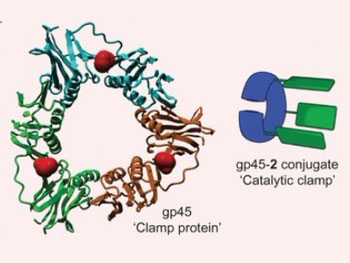
正如文章通信作者Roeland Nolte所解释的那样,“存在能够复制 DNA 的天然酶。这些酶都是环状结构,并利用这种环状结构夹住另一种酶(即复制性催化剂)。我们对这种天然的环状结构进行修饰,引入卟啉分子,结果就是这种体系能够裂解 DNA。受自然的启发,我们因此构建出我们自己的可修饰的生物杂合催化剂(biohybrid catalyst)。”
控制在 DNA 上的滑动方向
这种可修饰的催化剂实际上并不是一种环状结构,而是一种具有狭窄孔隙的 c 型结构。这意味着它能够轻松地结合到 DNA 上,并在其上滑动。当这种催化剂滑动时, 它只在特异性的碱基序列--- DNA 中的AAA重复序列---上裂解 DNA。Nolte说,“我们也能够影响这种催化剂的作用方向,让它从 DNA 的左边或右边滑动。我们是通过在 DNA 的一边进行分子阻断而完成的,因此这种催化剂只能够从另一个方向进行滑动。”
分子计算机
类似这种催化剂的分子机器在有机化学中是非常有用的,这是因为它们能够以一种受控的方式进行裂解 DNA 。Nolte 解释道,“我们的最终目标就是获得一种完全是人工合成的催化剂,这样我们就会在不同的溶剂中使用它,但是就当前而言,我们只能够在水溶液中让它发挥作用。我想象的就是这种人工合成的催化剂应是一种分子计算机,能够利用输入信息执行精确的任务。”
可视化观察裂解位点
研究人员利用他们自己开发出的一种新技术精确地展现这种催化剂是在 DNA 哪个位点上执行这种裂解行为的。这种裂解行为在 DNA 上产生一种功能性基团,随后经过链霉素处理后,利用原子力显微镜(Atomic Force Microscopy, AFM)就能够可视化这种基团。利用这种新技术,他们能够检测 DNA 上的裂解位置,因此就能确定这种催化剂是否确实在指定的方向上滑动。
原文链接:
A clamp-like biohybrid catalyst for DNA oxidation
Stijn F. M. van Dongen, Joost Clerx, Kasper Nørgaard, Tom G. Bloemberg, Jeroen J. L. M. Cornelissen, Michael A. Trakselis, Scott W. Nelson, Stephen J. Benkovic, Alan E. Rowan &Roeland J. M. Nolte
In processive catalysis, a catalyst binds to a substrate and remains bound as it performs several consecutive reactions, as exemplified by DNA polymerases. Processivity is essential in nature and is often mediated by a clamp-like structure that physically tethers the catalyst to its (polymeric) template. In the case of the bacteriophage T4 replisome, a dedicated clamp protein acts as a processivity mediator by encircling DNA and subsequently recruiting its polymerase. Here we use this DNA-binding protein to construct a biohybrid catalyst. Conjugation of the clamp protein to a chemical catalyst with sequence-specific oxidation behaviour formed a catalytic clamp that can be loaded onto a DNA plasmid. The catalytic activity of the biohybrid catalyst was visualized using a procedure based on an atomic force microscopy method that detects and spatially locates oxidized sites in DNA. Varying the experimental conditions enabled switching between processive and distributive catalysis and influencing the sliding direction of this rotaxane-like catalyst.

