生化与细胞所科研人员发现阐述蛋白质积聚产生细胞毒性的新机制
9月18日,国际学术期刊Scientific Reports 在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所胡红雨研究组的研究论文“Aggregation of polyglutamine-expanded ataxin-3 sequesters its specific interacting partners into inclusions: Implication in a loss-of-function pathology”。 该论文提出蛋白质积聚募集其特异相互作用的蛋白质的新观点,从而引起细胞功能丧失并产生细胞毒性。该研究为进一步阐明神经退行性疾病的致病机理以及预防和治疗疾病提供了新的思路。
某些神经退行性疾病是由于体内蛋白质的错误折叠和积聚所引发的,称之为“构象病”。多聚谷氨酰胺(PolyQ)区域延伸可导致蛋白质错误折叠,并在细胞中形成不可溶的积聚物或包涵体。然而,这些积聚物或包涵体是如何使细胞失去正常功能(或产生毒性)而引起神经元功能失调尚不清楚。
博士研究生杨慧等以PolyQ蛋白Ataxin-3 (Atx3)为模型研究了PolyQ延伸所引起的蛋白质包涵体募集正常蛋白质的细胞效应及分子机制。他们的研究成果表明PolyQ延伸的Atx3能够特异性地将细胞中与之相互作用的蛋白质如泛素化蛋白质和P97/VCP蛋白募集到积聚沉淀物中,这种特异性的募集作用会使P97/VCP调控NEDD8修饰水平的功能受损。体外研究表明PolyQ的延伸或缩短既不会改变PolyQ周围结构域的构象,也不影响与其它蛋白质相互作用的强度。因此,他们认为PolyQ延伸的直接效应是使Atx3更易积聚,使蛋白质从可溶状态变成不可溶的积聚物;在积聚过程中使细胞中与之相互作用的正常蛋白质被挟持下来,从而引起它们功能受损并导致细胞毒性,而这可能是多种神经退行性疾病的一个共同的致病原因。
该项研究工作得到了国家科技部、基金委、中国科学院的经费支持。(生化与细胞所)
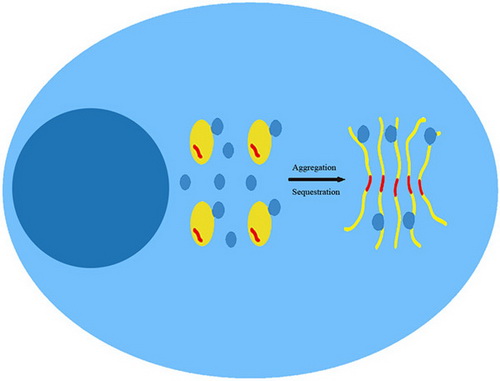
图示:细胞中PolyQ 积聚物挟持特异相互作用蛋白质的过程。PolyQ蛋白自积聚,并象滚雪球一样募集与之特异相互作用的蛋白质到不溶沉淀物中。 这种募集效应引起相关蛋白质的功能失调和细胞毒性[参论文 Yang et al, Sci. Rep., 2014, 4, 6410]。

