隐藏的遗传复杂性通过多种意想不到方式帮助细菌进化出抗生素耐药性
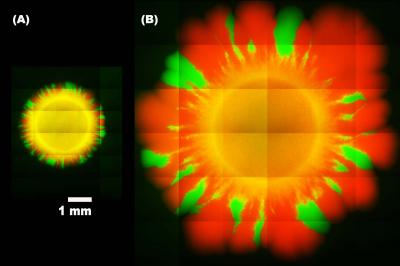
图片展示了两类大肠杆菌菌株(野生型和GASP)在平坦表面生长时彼此竞争的状态。 野生菌株是绿色,GASP是红色。 当科研人员把细菌放入到更为复杂的微液体仪器时,他们观察到了菌株迅速进化出不同类型的抗药性变异。
图片来源: Robert Austin/普林斯顿大学
致病细菌能够进化出抗生素耐药性的能力在世界范围内对人类健康造成越来越多的威胁。科学家们现已发现我们的微观敌人也许比我们预计的还要狡猾, 它们在压力环境中通过隐藏的基因变化促进迅速进化, 并通过比我们预想的还要多的方式发展出对抗生素的耐药性。 一篇发表在美国物理联合会出版的《生物微流体》杂志上的新文章报道了该研究结果。
文章中, 来自新泽西州普林斯顿大学的研究人员报道了他们所发现的两类相似的大肠杆菌菌株如何通过截然不同的基因突变迅速发展出相似水平的抗生素耐药性。能够使用不同的方法解决相同的问题说明细菌能够发展出多种多样的基因武器对抗抗生素, 从而使它们具有更强的应变能力从而更不易被消灭。
“细菌们很聪明—他们有很多隐藏的方式对抗压力,包括重塑它们的基因组,” 该科研团队的领头人,普林斯顿大学生物物理学家Robert Austin说。
意识到细菌是会多么有效地对抗药物是令人深思的,Austin说。“这教导我们在抗生素的使用方面一定要比现在更加谨慎小心。”
加速进化
Austin和他的同事专门致力于开发一些独特的,充满液体的微结构来检测细菌进化的理论。Austin强调,他们不使用试管和皮氏培养皿—那 些均匀的环境只存在于“象牙塔”里,他们所要建造的是那些在他们看来更好的模拟自然生态微环境的仪器。
研究团队使用了一种定制的微流体仪器, 它包含大约1000个相连的可供细菌种群生长的微生境。该仪器可产生类似于在细菌自然生存环境,如消化道和人体其他内部结构中所发现的复杂的食物梯度和抗生素。
“在复杂环境中, 细菌抗药性的产生要远比在试管实验中来的迅速和复杂。”Austin说。
在以往使用微结构仪器的实验中,研究人员已经了解到一些普通的,野生型大肠杆菌菌株能够很快的进化出抗药性。另有一种叫GASP的突变菌株,它们在有限的营养物中比野生菌株繁殖的更快,研究人员想知道该突变菌株在接触相同的抗生素时是否会产生出和野生菌株相同类型的抗药性。
秘密武器揭晓
通过对接触过抗生素环丙沙星(Cipro)的野生型和GASP突变型菌群的基因组排序,研究人员发现不同的基因变异可以导致相似水平的抗药性。比如, 在GASP中有两种不同的突变菌株出现:一种抗药的GASP菌株,它的进化方式是通过从感染细菌的病毒中”借用”DNA残片,从而成为了不需要生物膜就可以在外界压力中存活的菌株。另外一种抗药GASP菌株没有通过“嫁接”这一途径,而是通过其他几种方式最终也产生了抗药性。
病毒通常会把他们的DNA注射到细菌中去,这些DNA有时不再具有病毒复制的功能。 通常情况下,这些 DNA残片对细菌既无助力也无阻力,但在压力环境下,细菌可以利用新的DNA迅速地进化出抗药性变异。
研究人员的结果证实了细菌对抗压力环境的方法的多样性和其狡猾之处, Austin说。他想进一步了解我们现用的杀灭细菌的有效方法,比如用酒精消毒物体表面, 是否也有其脆弱性,他的研究团队计划测试细菌能否在他们的仪器中进化出对酒精的抗药性。
原文摘要:
You cannot tell a book by looking at the cover: Cryptic complexity in bacterial evolution
Qiucen Zhang, Julia Bos, Grigory Tarnopolskiy, James C. Sturm, Hyunsung Kim, Nader Pourmand and Robert H. Austin
Do genetically closely related organisms under identical, but strong selection pressure converge to a common resistant genotype or will they diverge to different genomic solutions? This question gets at the heart of how rough is the fitness landscape in the local vicinity of two closely related strains under stress. We chose a Growth Advantage in Stationary Phase (GASP)E scherichia coli strain to address this question because the GASP strain has very similar fitness to the wild-type (WT) strain in the absence of metabolic stress but in the presence of metabolic stress continues to divide and does not enter into stationary phase. We find that under strong antibiotic selection pressure by the fluoroquinolone antibiotic ciprofloxacin in a complex ecology that the GASP strain rapidly evolves in under 20 h missense mutation in gyrAonly 2 amino acids removed from the WT strain indicating a convergent solution, yet does not evolve the other 3 mutations of the WT strain. Further the GASP strain evolves a prophage e14 excision which completely inhibits biofilm formation in the mutant strain, revealing the hidden complexity of E. coli evolution to antibiotics as a function of selection pressure. We conclude that there is a cryptic roughness to fitness landscapes in the absence of stress.
作者:eurekalert

