清华大学生命科学院李蓬研究组在Developmental Cell发文揭示Rab8a-AS160-MSS4调节通路控制脂滴生长的分子机制
2014年8月25日,清华大学生命学院教授、清华-北大生命科学联合中心研究员李蓬研究组在《Developmental Cell》杂志上发表featured article,题为“Rab8a-AS160-MSS4 Regulatory Circuit Controls Lipid Droplet Fusion and Growth”。该论文首次揭示了Rab8a参与Fsp27介导的脂滴融合过程的分子机制,为进一步以脂滴为药物靶点来治疗脂紊乱疾病提供了重要的理论依据。
脂代谢紊乱能够引起多种代谢性疾病如肥胖、糖尿病、脂肪肝、动脉粥样硬化等,严重危害人类健康。脂滴(Lipid Droplet)作为脂代谢的核心细胞器能够特异地储存中性脂,其数目和大小与脂稳态调控有密切关系。长久以来,关于脂滴是如何生成、生长的问题一直悬而未决。
李蓬研究组首次发现了Rab8a是Fsp27介导的脂滴融合过程中的直接参与因子。Fsp27通过在脂滴-脂滴接触点(LDCS)富集介导脂肪的转移来诱导脂滴融合长大。Rab8a通过与Fsp27直接相互作用被招募到LDCS上,促进脂滴融合。有趣的是, GDP-Rab8a,而不是GTP-Rab8a,是促进Fsp27功能的活性形式。在ob/ob小鼠的肝脏中特异性敲低Rab8a,缓解了脂肪肝的症状。进一步的研究发现,Rab8a的GAP(GTPase Activating Protein) AS160能够通过Rab8a促进脂滴的增长。在脂肪细胞中AS160能够定位在脂滴上,通过与Fsp27的相互作用在LDCS上与Rab8a,Fsp27形成三元复合体,促进脂滴融合。MSS4作为Rab8a的GEF (guanine nucleotide exchange factor)负向调控脂滴融合过程。本论文揭示了一个全新的脂滴融合调节机制。
清华大学生命科学学院的博士生吴丽贞、徐迪进和博士后周林康是本论文的共同第一作者。本论文的通讯作者为李蓬教授。本工作获得了科技部、国家自然科学基金委、清华-北大生命科学联合中心的经费支持。
论文链接:http://www.cell.com/developmental-cell/abstract/S1534-5807(14)00447-X
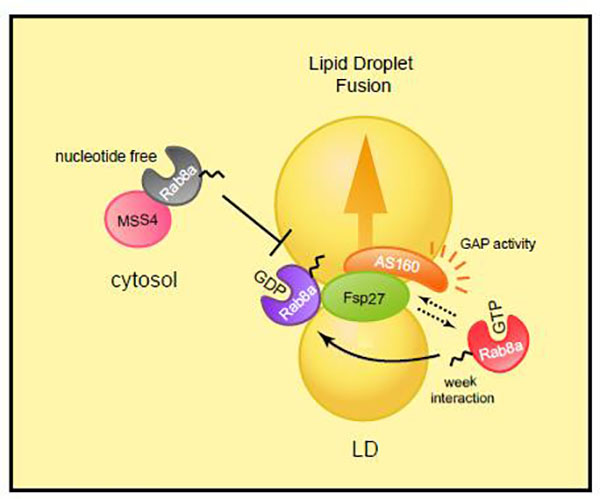
Rab8a、 AS160与Fsp27在LDCS上形成三元复合体,促进脂滴融合。MSS4通过抑制Rab8a-GDP的形成抑制脂滴融合。

