清华大学生命科学学院欧光朔研究组在《Developmental Cell》上发表利用体细胞CRISPR-Cas9技术实现线虫条件性基因敲除方法的论文
2014年8月21日,清华大学生命科学学院欧光朔研究组在《Developmental Cell》杂志上在线发表题为“Conditional Knockouts Generated by Engineered CRISPR-Cas9 Endonuclease Reveal the Roles of Coronin in C. elegans Neural Development”(利用人工CRISPR-Cas9核酸酶进行条件性基因敲除揭示Coronin在线虫神经发育中的作用)的研究论文。该工作利用体细胞表达CRISPR-Cas9核酸酶,在线虫中实现了高效快捷的条件性靶向基因组编辑。
条件性基因突变方法是在分子水平上研究细胞和发育生物学的关键技术。基于Cre-LoxP和Flp-FRT系统的条件性基因敲除方法被广泛应用于多种模式动物中,但该方法实验周期漫长,成本昂贵。近来,两种人工核酸酶,包括转录活性样效应因子核酸酶(Transcription activator-like effector nucleases)和CRISPR-Cas9(clustered regularly interspaced short palindromic repeat (CRISPR)/CRISPR-associated (Cas) system)核酸酶,对许多物种的基因组实现了高效的靶向编辑。欧光朔研究组2013年在《Nature Biotechnology》报道了体细胞时空特异表达的TALEN核酸酶对线虫的目标基因进行条件性突变的方法。沿用相似的思路,欧光朔研究组在线虫体细胞中特异的表达Cas9核酸酶,实现了对九个不同的基因进行了条件性突变。与体细胞TALEN技术比较,体细胞CRISPR-Cas9技术在多个位点上更为高效,而且操作更为便捷。以此为基础,欧光朔研究组实现一步对两个或三个基因同时进行性敲除。
欧光朔研究组结合体细胞CRISRP-Cas9技术、体细胞TALEN技术和活体显微成像方法,揭示了Coronin蛋白在神经发育过程中的作用。Coronin的突变存在于严重联合免疫缺陷(severe combined immune deficiency)或神经行为功能缺失(human neurobehavioral dysfunction)等人类疾病中,然而Coronin的发挥功能的细胞学机制不清楚。线虫Coronin同源基因的突变导致胚胎致死。通过条件性基因突变方法,欧光朔研究组发现Coronin在线虫神经前体细胞迁移过程中,调控微丝细胞骨架的周转(turnover),保持游离状态G-actin和聚合状态F-actin之间的动态平衡,确保迁移细胞的正确形状和迁移距离。
欧光朔研究组的工作表明体细胞CRISPR-Cas9技术可以在多细胞生物内对体细胞基因组进行高效快捷的突变,从构建表达载体到线虫表型分析仅需要1~2周。体细胞CRISPR-Cas9技术在其他物种的条件性基因突变实验中也可能具有广泛的应用前景。
清华大学生命科学学院的博士生沈忠福、张贤亮和博士后柴咏平是本论文的共同第一作者。本论文的通讯作者为欧光朔研究员。本工作获得了科技部、国家自然科学基金委、清华-北大生命科学联合中心以及青年千人计划的经费支持。
论文链接:http://www.cell.com/developmental-cell/abstract/S1534-5807(14)00483-3
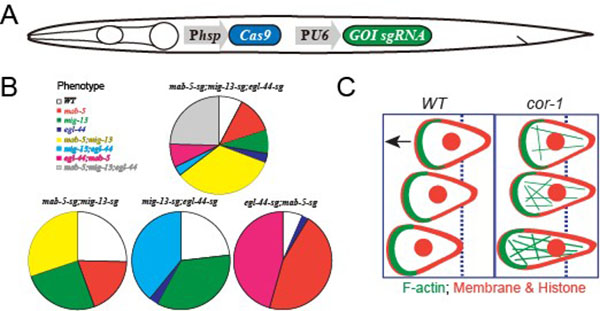
A. 线虫体细胞CRISPR-Cas9条件性基因敲除方法技术策略简图。B. 利用体细胞CRISPR-Cas9技术一步对两个或三个基因同时实现条件性敲除后表型统计。C. Coronin在线虫胚后神经前体细胞发育中,调控微丝细胞骨架的周转,确保迁移细胞的正确形状和迁移距离

