PNAS:动态调控微生物代谢途径高效生产新型生物能源–脂肪酸
近日伦斯勒理工学院(Rensselaer Polytechnic Institute) MattheosKoffas领导的代谢工程团队开发了一种高效的生产脂肪酸的方法,利用此法所获得脂肪酸可用于生物能源、药物和精细化工中间体的合成。此项目由美国国家自然科学基金资助,过去两年的研究成果已经发表在最近出版的2014年8月5日美国科学院院刊(PNAS, Proceedings of National Academy of Sciences)。
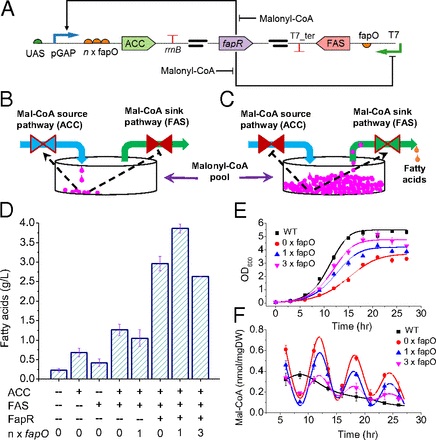
Koffas及其团队利用合成生物学的手段开发了控制脂肪酸合成的生物开关,此开关能够实时调控细胞内丙二酸单酰辅酶A (malonyl-CoA) 的含量。通过在细胞水平上动态调控丙二酸单酰辅酶A的含量,研究者们能够优化脂肪酸的合成,同时解除了过量前体化合物对细胞生长的抑制。
利用此法合成的脂肪酸本质上与天然植物或者微生物来源的脂肪酸并无二致,这些脂肪酸可以做为药物中间体或者生物能源。脂肪酸在生物能源中能量密度最高、便于储存、不容于水,以及与汽油柴油等发动机兼容,在生物能源研究中成为研究者的新宠。目前的瓶颈是自然界中的微生物并不能过量合成脂肪酸,为了使大肠杆菌高效合成脂肪酸,Koffas研究团队利用合成生物学手段动态优化了控制脂肪酸合成的关键代谢途径。
在此之前研究者多用静态调节优化代谢产物合成,静态调节一般直接激活或者关闭某条代谢途径,这种方法固然有其优势,所构建的菌株往往需要浪费很多资源去打开或者关闭某一条代谢途径,不可避免的造成生产效率低下。该研究团队构建了能够识别胞内丙二酸单酰辅酶A水平的生物开关,根据细胞本身的状态,细胞自身能够决定哪一些基因需要激活或者抑制。当细胞感知到丙二酸单酰辅酶A水平较低时,就会增加合成丙二酸单酰辅酶A的基因;相反,当细胞感知到丙二酸单酰辅酶A水平较高时,就会增加脂肪酸合成酶基因的表达,从而消耗积累的丙二酸单酰辅酶A。
Koffas及其团队开发的生物开关主要基于两个转录行为迥异的启动子,这两个启动子对细胞内的丙二酸单酰辅酶A表现出相反的转录活性。当胞内丙二酸单酰辅酶A积累时,其中一个启动子能够关闭丙二酸单酰辅酶A的合成途径;当胞内丙二酸单酰辅酶A稀缺时,另一个启动子能够打开丙二酸单酰辅酶A的合成途径。这一动态调控的策略开创了优化丙二酸单酰辅酶A衍生化合物的新的方法,相同的动态调控方法不仅可用于生产生物能源,也可用于生产其他具有商业价值的丙二酸单酰辅酶A衍生物,包括天然多聚酮、黄酮和多不饱和脂肪酸等附加值较高的化合物。
该研究成果由伦斯勒理工学院博士生、麻省理工学院博士后徐鹏为第一作者,合作者包括伦斯勒理工学院的张福明教授和麻省理工学院的杰出教授Gregory Stephanopoulos先生。
原文摘要:
Improving fatty acids production by engineering dynamic pathway regulation and metabolic control
Peng Xu, Lingyun Li, Fuming Zhang, Gregory Stephanopoulos and Mattheos Koffas
Global energy demand and environmental concerns have stimulated increasing efforts to produce carbon-neutral fuels directly from renewable resources. Microbially derived aliphatic hydrocarbons, the petroleum-replica fuels, have emerged as promising alternatives to meet this goal. However, engineering metabolic pathways with high productivity and yield requires dynamic redistribution of cellular resources and optimal control of pathway expression. Here we report a genetically encoded metabolic switch that enables dynamic regulation of fatty acids (FA) biosynthesis in Escherichia coli. The engineered strains were able to dynamically compensate the critical enzymes involved in the supply and consumption of malonyl-CoA and efficiently redirect carbon flux toward FA biosynthesis. Implementation of this metabolic control resulted in an oscillatory malonyl-CoA pattern and a balanced metabolism between cell growth and product formation, yielding 15.7- and 2.1-fold improvement in FA titer compared with the wild-type strain and the strain carrying the uncontrolled metabolic pathway. This study provides a new paradigm in metabolic engineering to control and optimize metabolic pathways facilitating the high-yield production of other malonyl-CoA–derived compounds.
作者:徐鹏

