转基因木瓜的由来
发表日期:2014-06-28 02:13AM 阅览次数:
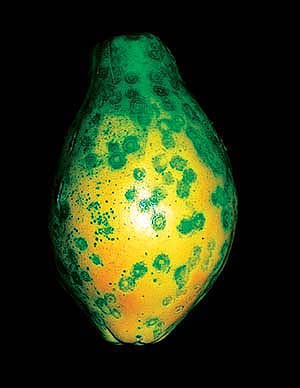
木瓜感染环斑病毒后,仅从卖相就不会受到消费者欢迎。图ucanr.org
作者:许东林(华南农业大学植物病理学博士生,搜狐微博:铁冰)
为何植物抗病毒必须转基因?
农作物在生长过程中会受到多种有害生物的侵害。大部分植物病虫害主要靠化学农药来防治,农药可以有效地杀死农作物害虫、杂草和植物病原真菌、细菌、线虫,但对植物病毒不起作用。
病毒侵入动、植物体内之后,利用宿主细胞里的资源,大量复制自己的基因组并制造新的蛋白质外壳,再组装起来,就形成了许多新一代的病毒颗粒,然后去感染宿主更多的细胞和器官。由于化学药物通常无法抑制病毒在宿主体内的复制、增殖,几乎所有由病毒引起的人类或动物疾病都没有特效药可治(“达菲”能治流感是极少数的例外),只能靠免疫系统产生抗体来对付病毒,如果能成功地把病毒清除掉,病就好了(如普通感冒)。然而植物不具备像人类和动物那样的免疫系统,不能产生抗体来消灭病毒,这就使得植物病毒病非常难以防治。
筛选和培育抗性品种是防治农作物病虫害的另一有效方法。一些作物的某些品种或它们的亲属野生物种可能具有抗虫、抗病基因,把普通栽培品种和它们进行杂交,就有可能获得抗性基因。数十年来人们获得了许多抗虫、抗病的农作物杂交品种。但是,并非对于每一种病虫害,自然界都存在相应的抗性植物可为杂交育种所用,即使能找到抗性材料,育成一个抗性品种也需要大量的试验、筛选工作,往往耗时十年之久,十分繁琐。而且对植物病毒来说,它们变异速度很快,非常容易突变出能克服植物抗病毒基因的新毒株,使杂交育种之效化为乌有。
转基因抗病毒育种是防治植物病毒最有效的方法。要抗哪种病毒,就给植物转入一个该病毒的基因。那么病毒基因跑到植物体内后是如何把病毒自身杀死的呢?转基因植物对病毒的抗性,同对害虫、病菌的抗性机理完全不同。我们知道,把某种毒性较弱的病毒株系(或经过失活处理的病毒)也就是疫苗注射到人或动物体内之后,病毒的外壳蛋白可诱导免疫系统产生相应的抗体,等下次遇到这种病毒入侵时,抗体就能跟病毒发生免疫反应,使其失去活力。类似的做法是否也能使植物获得对病毒的抗性呢?
早在上世纪20年代末,人们就发现接种了弱毒株病毒之后的植物确实能对同种病毒的强毒株产生抗性,这被称为“交叉保护”现象。许多植物病毒的弱毒株都可以诱导产生交叉保护现象,但植物并不具备像人或动物那样的免疫系统,人们也从未在植物体内发现过针对病毒的抗体,尽管交叉保护现象跟人或动物注射疫苗后对病毒产生的抗性很相像,二者的机制应该是大不相同的。上世纪七八十年代,科学家们提出过几种假说,试图解释交叉保护的机制。例如其中一种假说认为,给植物接种弱毒株后,病毒在自我复制时合成出大量外壳蛋白,而随后侵入的强毒株病毒在自我复制前要先把它的核酸从其外壳蛋白中释放出来,但刚一释放出来就被弱毒株的外壳蛋白重新包裹起来,从而无法成功复制。这些假说都未能得到证实,关于交叉保护机制更加可靠的解释,要等到新旧世纪之交才被人们所知。
在“知其然而不知其所以然”的年代,人们利用交叉保护现象对一些植物病毒进行防治,取得了不错的效果。但是,对于大量种植(例如几十万株)的作物来说,为了防治病毒,就要对所有的植株逐一进行弱毒株接种,这显然是一项无法完成的工作。另外,并不是每一种植物病毒都存在毒性强弱有别的多个株系,如果某种病毒恰好没有弱毒株,这个办法就行不通了。
转基因木瓜缘何产生?
于是转基因技术就成为必然选择。把病毒的外壳蛋白基因转到植物体内,可以得到跟交叉保护相似的效果:对转基因植株接种同一种病毒并不能使其发病,植株体内也检测不到病毒。1986年,人们把烟草花叶病毒的外壳蛋白基因转入烟草,获得了世界上第一例抗病毒转基因植物。
其后20多年里,科学家们对几十种植物病毒进行了试验,证实向植物转入病毒基因是行之有效的抗病毒育种途径。目前世界上已被获准商品化种植的抗病毒转基因作物有木瓜、马铃薯(美国育成,2001年因销路不佳不再销售)、葫芦瓜(美国育成,转基因所占比例13%)等。中国也培育出了多种抗病毒转基因作物,但目前仅有2种(辣椒、木瓜)获得农业转基因生物安全证书(已获得安全证书的转基因作物在中国仅有7种),且只有转基因木瓜在广东省被商品化种植。
木瓜又叫番木瓜,有“岭南佳果”的美誉。1948年,人们在美国夏威夷发现了一种侵害木瓜的植物病毒,即番木瓜环斑病毒(PRSV)。随后几十年里,该病毒在世界多个木瓜产地均有发生,包括在中国南方多个省份广泛流行,严重时可导致木瓜减产八九成,成为木瓜产业的主要限制因素。
好在科学家们及时地培育出了抗番木瓜环斑病毒的转基因木瓜。1990年,首个转番木瓜环斑病毒外壳蛋白基因的木瓜品系诞生,1992年人们在夏威夷开发出两个转基因品种“日出”和“彩虹”,它们在1998年被批准商业化种植,直接挽救了美国的木瓜产业。美国转基因木瓜2003年被加拿大、2010被日本批准进口,2011年底被日本批准种植,此外在泰国也得到了推广种植。
番木瓜环斑病毒是一种变异性很强的RNA病毒,在全世界共有几十个毒株,不同地区的毒株之间在感染木瓜的能力上存在较大差异。夏威夷的转基因木瓜品种对当地的番木瓜环斑病毒毒株有很高的抗性,但对其他地区的毒株抗性不高甚至没有抗性。为此,中国科学家自主研发了能够抵抗国内毒株的转基因木瓜。
中国的木瓜产地在华南地区,而华南地区有4个番木瓜环斑病毒毒株,其中“黄点花叶”株是优势毒株(80%以上的发病木瓜携带这个毒株)。华南农业大学的科研人员将这个毒株的复制酶基因转入木瓜体内,培育出了“华农1号”。该品种不仅高抗“黄点花叶”株,对华南地区其他几个次要毒株也具有很好的抗性。“华农1号”在2006年获得中国农业部颁发的安全性证书,可在广东省生产应用。此后得以大规模种植,产生了巨大的经济效益,深受瓜农喜爱。目前国内市场上销售的木瓜基本上都是转基因品种(包括从美国进口的转基因品种)。
为什么“华农1号”的研究者选择转入番木瓜环斑病毒的复制酶基因,而不是跟别的抗病毒作物、甚至夏威夷的转基因木瓜一样,也转入病毒的外壳蛋白基因呢?一个原因是人们发现转外壳蛋白基因的木瓜对病毒的抗性还不够强,另一个原因是出于对一种潜在风险的考虑。许多植物病毒可以由昆虫进行传播,番木瓜环斑病毒可由蚜虫传播。蚜虫在含有病毒的木瓜树上吸食汁液时,番木瓜环斑病毒通过外壳蛋白依附在蚜虫的刺针上,然后蚜虫再去吸食下一棵木瓜,就把病毒传过去了。有些植物病毒由于其外壳蛋白不能跟蚜虫的刺针结合,因此没有蚜传特性。科学家们担心,如果转外壳蛋白基因的木瓜植株里恰好有另一种不具有蚜传性的病毒,那么后者的核酸会不会被番木瓜环斑病毒的外壳蛋白包裹起来,从而变成一种可以被蚜虫传播的、更容易流行的“新”病毒呢?因此,如果转入的不是外壳蛋白基因,而是病毒别的基因,显然就能避免这种潜在的“张冠李戴”可能。
值得指出的是,目前人们从没发现转外壳蛋白基因导致植物病毒的“张冠李戴”真正发生过。这也说明科学家们对转基因作物的研发是非常谨慎的,他们会事先考虑各种可能的不良后果,并加以避免。
“华农1号”是否安全?
“华农1号”上市之前,各种常规的安全性评价实验更是少不了。人们首先把番木瓜环斑病毒的复制酶蛋白序列跟目前已知的8类过敏源(分别来自花生、大豆、坚果、小麦、牛奶、鸡蛋、鱼类和贝类)的蛋白序列进行比较,并未发现相似性,由此判断番木瓜环斑病毒复制酶蛋白并不属于已知的过敏源。
接着通过基因工程技术把这个复制酶基因转入细菌体内(这也是一种“转基因”),让细菌大量制造复制酶蛋白,再提取出来,用人工模拟的人类胃液(含有胃蛋白酶,强酸性环境)和肠液(含有胰蛋白酶,弱碱性环境)进行模拟消化实验。结果显示番木瓜环斑病毒的复制酶蛋白在肠液、胃液中被消化15秒钟之后就失去了活性,说明人体可正常消化转基因蛋白。最后,由于木瓜本身含有一种名叫苄基异硫氰酯的天然毒素,人们比较了这种毒素在转基因和非转基因木瓜体内的含量,发现转基因木瓜并不比非转基因木瓜含有更多的毒素——这叫“实质等同性”。上述这些试验证明了食用转基因木瓜是安全的。
事实上,在转基因木瓜诞生之前,人们已长期食用过被番木瓜环斑病毒侵害的木瓜,等于把整个病毒都吃进去了,却从来没有因此出现过健康问题。须知这种病毒一共有10个基因,会制造出10个病毒蛋白,而转基因木瓜只制造一个病毒蛋白(外壳蛋白或复制酶蛋白),如果转基因木瓜不安全,那么非转基因木瓜岂非十倍地更不安全?
转基因木瓜中除了含有番木瓜环斑病毒的复制酶基因,还含有一同转进去的一些别的成分,包括35S启动子、NOS终止子和卡那霉素抗性基因。其中前二者是使转入的基因得以表达的零件,其本身并不产生蛋白质产物;后者可使转基因植株获得对卡那霉素的抗性,以便人们用这种抗生素把没能转入基因的植株杀死,把转入成功的植株筛选出来。许多转基因作物都含有这个基因。
有人担心,转基因作物中的卡那霉素抗性基因会不会在环境中扩散,让别的生物尤其是细菌因此获得抗药性,或者人食用了转基因作物后,会不会把这个基因“转”给肠道里的细菌,使其产生耐药性?卡那霉素抗性基因本来就来自细菌,它广泛地天然存在于自然界,因此转基因作物并不会在这方面给大自然“添乱”,而目前也从未发现过人的肠道内细菌被“转”入这个基因。欧盟食品安全局2010年曾做过一个评估,结论是转基因作物中的卡那霉素抗性基因对人与动物的健康、对环境没有风险。
基因沉默是转基因抗病毒实质
就在美国和中国相继研发出转基因木瓜的十几年里,生命科学、分子生物学的一项重大发现使人们对植物转基因抗病毒的具体机制终于有了比较清楚的了解。
1990年,美国科学家乔根森研究矮牵牛花时,希望使它的花色变得更深,就把一个查尔酮合成酶基因转入矮牵牛中。矮牵牛本来含有一个查尔酮合成酶基因,它能合成花青素,使牵牛花呈紫色。乔根森原本以为,转基因矮牵牛既然拥有两个查尔酮合成酶基因,就会加倍制造花青素,使花色更深。但结果却出乎他的意料,转基因矮牵牛的花色不仅没有加深,反而变成了白色。显然,转进去的和矮牵牛原有的查尔酮合成酶基因都没有得到表达,而是“共同沉默”了。
随后科学家们在真菌、线虫、昆虫等许多物种体内也发现了“基因沉默”现象。1998年,美国科学家安德鲁•菲尔和克莱格•梅洛以线虫为研究材料,发现如果把跟线虫某个基因的序列具有相似性的双链RNA分子注射到线虫体内,就会导致那个线虫基因被“沉默”掉。人们很快发现这一被称为“RNA干扰”的过程具有普遍性,即动、植物体内的“基因沉默”过程都有双链RNA分子参与。这两位科学家因此获得2006年诺贝尔生理及医学奖。
一般而言,生物基因首先以DNA序列为蓝本,合成一条信息RNA即mRNA(该过程叫“转录”),然后根据mRNA上的信息来合成一条氨基酸肽链(这叫“翻译”),后者再构成蛋白质,行使相应的生命功能。至此,一个基因就得到了“表达”。科学家们发现,上文说到的生物体内的“基因沉默”现象,其原因是生物基因被转录成mRNA之后,mRNA在被翻译成蛋白质之前就先被降解了。因此应该把这种现象更准确地叫做“转录后的基因沉默”。那么,为什么会有这种机制呢?
一个生物体经常会被病毒等病原物入侵,病原物的基因对生物体来说属于外来核酸,而外来核酸(DNA或RNA)一旦进入细胞,就有可能对生物自身的基因造成破坏,影响其生存。于是自然选择的压力使得生物在漫长的岁月中进化出了一套抵御外来核酸入侵的自我保护机制,这就是转录后的基因沉默。外来核酸侵入细胞后,会在复制过程中形成双链RNA分子,后者可激活宿主体内的转录后的基因沉默机制,把外来核酸的mRNA降解掉,从而保护了宿主基因的安全。转录后的基因沉默有时也被称为“核酸水平上的免疫机制”。
既然生物普遍拥有这一自我保护机制,为什么人类和动植物还是会被许多病毒成功入侵,而罹患各种病毒病呢?那是因为该机制反过来对病毒形成了选择压力,病毒为了生存,也进化出了对付转录后的基因沉默的本领。科学家们发现许多病毒合成的一些病毒蛋白可以破坏转录后的基因沉默过程,从而使病毒得以在宿主体内存活、复制。例如番木瓜环斑病毒的10个蛋白中,有一个就是用于抑制转录后基因沉默机制。
培育转基因抗病毒植物,实际上就是人类在植物大战病毒的战场上助其一臂之力。转基因对植物来说也是外来核酸,同样可以激活植物的转录后基因沉默机制(这一激活发生在病毒入侵之前,使病毒来不及去抑制转录后的基因沉默过程),导致转基因跟入侵病毒的同一基因发生“共同沉默”。至此,人们明白了交叉保护现象产生的机制其实就是植物的转录后的基因沉默——接种弱毒株病毒跟转病毒基因作用相同。
人们用番木瓜环斑病毒接种到转复制酶基因的木瓜上,发现木瓜中复制酶基因的mRNA含量果然比借种病毒之前大幅度下降,证实了转录后的基因沉默正是转基因抗病毒的分子生物学机理。这一抗病机理依赖于转基因和病毒基因之间的同源性,病毒只有产生了很大的变异才有可能突破转基因植物的抗性。

