植物安全转基因技术研究现状与展望
来源:中国农业科学,作者:王根平,杜文明, 夏兰琴(中国农业科学院作物科学研究所/国家农作物基因资源与遗传改良重大科学工程),有删改
摘要:转基因技术是进行基因功能研究和作物遗传改良的重要工具。根癌农杆菌介导转化法和基因枪轰击法是两种主要的遗传转化方法。从1996 年首例转基因作物商业化种植以来,2012 年全球有28 个国家和地区种植转基因作物,种植面积已达1.7 亿公顷。随着全球转基因作物的大面积商业化种植,转基因植物的安全性越来越多地受到公众关注。安全转基因技术的研发对于转基因植物的商业化生产具有重要意义。文章详细介绍了目前已报道的安全转基因技术原理及其应用现状。按其作用原理和目的将其分为4 类:安全选择标记、标记基因删除及基因叠加、基因漂移防控法和基因定点编辑整合技术。其中,安全选择标记按其筛选原理分为糖代谢相关标记、氨基酸代谢相关标记、激素相关标记和抗逆相关标记。与抗生素和除草剂抗性标记相比,这类标记基因及其表达产物对人和其他生物更安全。标记基因删除及基因叠加技术包括共转化法、位点特异性重组法、转座子法、同源重组法以及基于位点特异性重组的基因叠加技术,其中共转化法又包括农杆菌介导的共转化法和基因枪介导的表达盒共转化法。基因叠加技术为复合性状转基因植物研发奠定了基础,有望成为未来多性状转基因植物研发的重要技术之一。基因漂流防控法包括叶绿体转化法和基因拆分法。基因定点编辑和整合技术包括锌指核酸酶、TALEN和CRISPR/Cas9 系统介导的基因定点编辑和整合技术。其中,TALEN 和CRISPR/Cas9 技术,设计简单,成本低,易操作,靶点分布广泛,有望成为安全转基因研发和应用的重要技术。文章对这些技术原理及其应用现状进行了综述,讨论了其优缺点,并展望了安全转基因技术研发重点和发展趋势。
尽管转基因作物产业化发展迅猛,但对其可能存在的潜在安全风险问题仍然受到公众的普遍关注。转基因作物的潜在安全风险主要是环境安全和食品安全风险。如在环境方面,由于花粉飘移可能形成超级杂草、增加靶标生物抗性、对生物多样性影响等。在食品安全方面,包括转入基因所表达蛋白质致敏性,以及对受体作物本身营养成分、天然毒素和抗营养物质含量等方面的影响及其他可能的非预期效应。此外,原核生物载体序列(骨架)和抗生素标记问题也会引起人们对转基因植物的安全性产生顾虑。
植物遗传转化方法很多,其中,根癌农杆菌介导法和基因枪轰击法是最常见的两种转化方法。农杆菌介导法的转化机理清楚、整合位点较稳定、拷贝数低、整合后的外源基因结构变异较小、遗传稳定性好,但存在基因型限制和骨架序列整合的情况;基因枪转化法不受材料基因型的限制,但存在着转基因的拷贝数多、沉默以及遗传稳定性等问题。
建立精准、安全的转基因技术体系已成为转基因技术研发的主要方向。目前,已报道了多种安全转基因技术,根据其原理和目的可分为以下四类:安全标记基因法、标记基因剔除与基因叠加、防止基因漂移的叶绿体转化法和基因拆分法以及基因定点修饰技术。其中, 标记基因剔除法包括共转化法(co-transformation)、位点特异性重组法(site-specificrecombination)、转座子法(transposon)、染色体同源重组法(intra-chromosomal recombination)。外源基因定点修饰技术包括锌指核酸酶介导的基因组定点修饰技术(ZFNs)、TALE 介导的基因组定点修饰技术(TALEN)和基于type Ⅱ 型的CRISPR/Cas(CRISPR/Cas)系统的基因定点编辑技术。本文就这些安全转基因技术的原理、应用和存在问题以及应用前景和发展方向进行了探讨。
1 安全标记基因的应用
使用安全标记基因是消除标记基因潜在风险的重要方法。与抗生素和除草剂抗性标记基因相比,这类标记在选择时并非直接杀死非转化细胞,而是使转化细胞处于有利的生长条件,使非转化细胞生长受到抑制,从而筛选出转化细胞,并且其基因和表达产物对人和其他生物无毒。目前,已开发了一系列安全标记基因。按其作用原理和选择剂类型,可分为以下几类(表一):

1.1 糖代谢相关基因
糖代谢相关基因编码的产物是某种糖类的分解代谢酶,通常植物细胞不能利用这些糖类作为主要碳源,但经相关代谢酶作用可转化为植物细胞可以利用的碳源。因此,在以该糖作为主要碳源的培养基上转化细胞能够正常生长,而非转化细胞生长受到抑制。目前使用较多的糖代谢相关标记基因是磷酸甘露糖异构酶基因(pmi)。甘露糖本身对植物细胞是无毒的,但它通过己糖激酶转化为甘露糖-6-磷酸时需消耗大量ATP,而且甘露糖-6-磷酸积累到一定浓度会抑制细胞的生长和发育。PMI 能使甘露糖-6-磷酸转化为果糖-6-磷酸,从而被植物细胞利用。pmi 选择标记基因已成功应用于小麦、水稻、玉米、甜菜、油菜、木薯等的遗传转化研究。如Gadaleta 等将甘露糖作为选择剂,将大肠杆菌(E.coli)的pmi 作为选择标记基因应用于小麦的转化研究,其平均转化率为1.14%,其选择效率可达90.1%,比用bar 基因作为选择标记时选择效率(26.4%)大大提高。目前,PMI 筛选系统作为先正达公司的PositechTM 选择技术,已应用于转基因植物的商业化生产。然而,pmi 筛选体系不适于那些自身含有内源pmi 的植物,如豆科类植物。
木糖异构酶基因(xylA)作为糖代谢标记基因,其原理与pmi 类似。XylA 能异构化D-木糖为D-木酮糖,在以D-木糖为筛选剂的培养基上,转化细胞能利用D-木糖,而非转化细胞生长受到抑制。Haldrup 等发现xylA 的筛选效率显著高于nptII,该系统已成功应用于玉米、油菜、向日葵等的转化。此外,也有报道将阿拉伯糖脱氢酶基因(atlD)、2-脱氧葡萄糖-6- 磷酸磷酸酯酶基因(DOGR1)等作为标记基因用于植物的转化研究。
1.2 氨基酸代谢相关基因
植物中某些氨基酸代谢途径中的关键酶受终产物的反馈抑制。利用这一特性,可将某些氨基酸代谢酶作为选择标记基因。天冬氨酸激酶(AK)为赖氨酸合成途径中的关键酶之一,其活性受赖氨酸或苏氨酸的反馈抑制。Perl 等以赖氨酸和苏氨酸作为选择剂,以大肠杆菌中对赖氨酸反馈抑制不敏感的lysC 作为筛选标记基因转化马铃薯,发现含有lysC 的转化细胞能够正常生长,而非转化细胞生长受到抑制。Brinch 等在大麦转化中发现,lysC 作为筛选标记基因容易产生白化苗和嵌合体,具有一定的局限性。此外,其他对反馈抑制不敏感的邻氨基苯甲酸合成酶(AS)基因ASA1、苏氨酸脱氨酶(TD)基因ilvA等也可作为筛选标记。
植物代谢途径中的氨基酸都为L-氨基酸,在植物体内少量D-氨基酸的累积,便可造成细胞危害,因此,一些D-氨基酸代谢酶也可用作标记基因。Oskar 等从Rhodotorula gracilis 中分离到D-氨基酸氧化脱氨酶(DAO)基因dao1,DAO 能够把D-丙氨酸和D-丝氨酸转化为无毒产物,同时也能把对植物有低毒性的D-异亮氨酸和D-缬氨酸转化为有毒的产物,因此,dao1 可作为双向选择标记基因。其他类似基因还有D- 丝氨酸氨解酶(DSD)基因dsdA等。
1.3 激素相关基因
在离体培养条件下,植物再生需要适宜的细胞分裂素和生长素比例。因此,通过在细胞中引入激素合成相关基因,从而提高芽的分化能力,也可作为筛选基因筛选转化细胞。农杆菌Ti 质粒编码的异戊烯基转移酶(IPT)是几种细胞分裂素前体物质的合成酶,ipt的表达会促进转化细胞内自身合成过量的激素,提高发芽和生根能力,而非转化细胞则受到抑制。ipt 已成功应用于烟草、水稻、白杨等植物的转化,特别是利用诱导型启动子控制ipt 的表达筛选效果更加稳定。此外,细胞分裂素受体基因CKI1、促进芽形态形成的增强子基因ESR1、发状根基因rol、基于负选择的β-葡萄糖醛酸酶基因uidA等也可以作为筛选基因。由于激素相关基因常会引起转基因植株的畸形,可通过结合位点特异性重组酶系统或转座子系统构建激素相关基因的选择系统,克服这种局限性。
1.4 抗逆相关基因
抗逆基因作为筛选标记已成功应用于植物转化的有OsDREB2A、AtSOS1 和rstB。OsDREB2A 编码DREB转录因子,受干旱和高盐诱导表达,AtSOS1 编码Na+/H+逆向转运蛋白基因,受高盐诱导表达。Zhu等用200 mmol•L-1 NaCl 作为筛选剂,分别将OsDREB2A 和AtSOS1 作为筛选基因应用于水稻转化系统。rstB 来自大豆根瘤菌RT19,编码糖基转移酶调控胞外多聚糖的合成。Zhang 等把rstB 作为筛选基因应用于烟草的转化,利用浓度为170 mmol•L-1 的NaCl 作为选择剂,其筛选效率最高可达83.3%。
总之,非抗生素或非除草剂抗性标记基因的使用,降低了转基因植株的潜在风险。然而,随着公众对转基因植物安全性意识的进一步提高,开发新型的尤其是植物来源的标记基因仍是一个重要研究方向。
2 标记基因删除和外源基因累加技术
目前,已发展了多种标记基因删除技术,包括共转化法、表达盒转化法、位点特异重组法以及基于位点特异性重组的基因叠加技术、转座子法和染色体同源重组法等。
2.1 共转化法剔除标记基因
共转化法是通过将标记基因和目的基因分别构建在不同载体或同一载体的不同T-DNA 区域一同导入受体,通过转基因植株自交后代的分离,获得只含有目的基因而不含标记基因的转化植株(MFTPs)。农杆菌介导的共转化法有三种形式:二质粒二菌株法;二质粒一菌株法;一质粒一菌株法(图1),具有操作简单、适用性广,且较易产生非连锁位点的特点。共转化法已经应用于烟草、拟南芥、油菜、水稻、大麦和玉米的转化研究。目前,研究较多的是一质粒一菌株法,即双T-DNA法,同一质粒上含有2个或多个T-DNA。
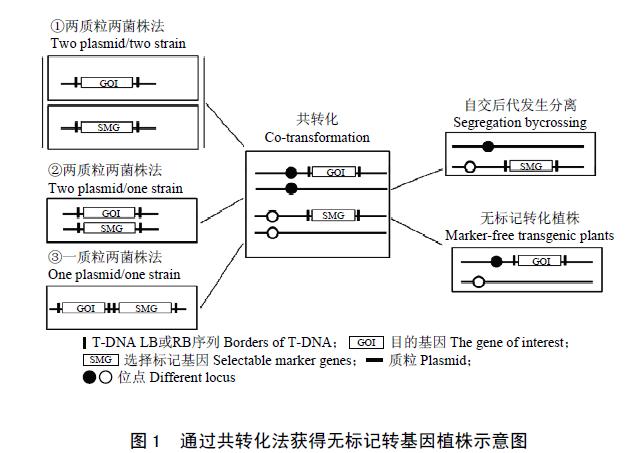
Komari 等使用此法转化烟草和水稻,发现其共转化率达47%,其中,50%的转化植株目的基因和标记基因位于不同位点,研究发现双T-DNA 共转化效率与T-DNA 的相对大小有关。此外,通过把标记基因构建到T-DNA 左边界外,目的基因位于T-DNA内,通过共转化,也可以获得无标记转化植株。
利用共转化法获得无选择标记植株,有3个关键因素:转化体系有较高的共转化率、T-DNA 可整合到不连锁位点、后代通过自交或杂交发生分离。因此,共转化法不适于无性繁殖的作物和生殖时间较长的物种。
2.2 基因枪介导的表达盒共转化法
通常利用农杆菌或基因枪介导法获得的转化植株,除了含有标记基因外,还会带有部分载体骨架序列。而载体骨架序列的存在可能会引起基因的重排,并且对外源基因或內源基因的表达有一定的影响。因此,在剔除标记基因的同时,减少骨架序列整合的转基因技术的开发受到重视。基因枪介导的表达盒共转化法是一个有效的方法。
该方法是把含目的基因的最小表达盒和含选择基因的最小表达盒,混合共转化受体,通过后代的分离获得无选择标记的植株。Fu 等首次获得了稳定表达bar 表达盒的转基因水稻植株,同时发现,与转化环型质粒或线性质粒相比,转表达盒的植株中bar 整合形式简单,拷贝低,基因重排率低。Breitler 等研究发现转表达盒和转质粒时的转化效率,没有显著差异。
Zhao 等把bar 表达盒和水稻白叶枯抗病基因cecropin B 通过基因枪法共转化水稻,并在后代的分离中获得了无bar 的植株,其无标记转基因植株的获得率约为6%。表达盒转化法在葡萄、马铃薯等植物中也已成功应用。另外,有试验表明,降低表达盒DNA 浓度可以提高单拷贝的转化体频率。
染色质中与核基质(或核骨架)相结合从而将染色质固定于核基质的DNA 序列称为基质附着区(MARs)或骨架附着区(SARs)。MARs 与SARs无本质区别,区别在于制备核基质时去除组蛋白步骤所用方法不同。MARs 是位于染色质端粒附近的一段保守DNA 序列,通常富含TA,长度一般为100 bp至数千bp 不等,能使染色质上间隔5—200 kb 的序列形成环状独立结构,提高基因的表达与稳定性。
因此,利用此特性可把MARs 序列置于外源基因的两翼,从而使外源基因整合到染色质独立结构区域,在一定程度上减少基因沉默,提高外源基因的稳定表达。邓智年等采用农杆菌介导法将带有MARs 和不带MARs 的野苋菜凝集素基因(AVA)转入白菜,发现利用MARs 序列不仅能提高AVA 的表达水平,降低株系间表达差异,同时也能提高转化效率。Allen 等把来源于鸡和烟草的MARs 序列置于gus 两侧,通过基因枪转化烟草悬浮细胞,发现gus 表达水平分别提高了24 倍和140 倍。
与动物相比,在植物中的MARs 序列研究虽然起步较晚,但已从多种植物中分离得到具有MARs 活性的DNA 片段,包括大豆、玉米、高粱、豌豆、水稻、拟南芥、胡萝卜等。尽管植物中MARs 的作用机制尚不清楚,但其在提高外源基因表达水平、降低转化体间表达差异以及减少基因沉默等方面的作用,对今后植物的安全转基因研究将有重要意义。
2.3 位点特异性重组法介导的标记基因删除和外源基因累加
2.3.1 位点特异性重组法介导的标记基因删除 同源重组在植物中是一种普遍现象。在噬菌体中存在一种重组系统,即重组只发生噬菌体和细菌染色体的特定位点,通常称作特异性重组位点。特异性重组位点由中间7—12 bp 的核心序列和两侧的回文序列构成,重组发生在重组酶蛋白结合区和核心序列间。当重组位点方向相同时,发生重组时就会删除两位点间的序列,可用于标记基因的删除,其原理见图2。
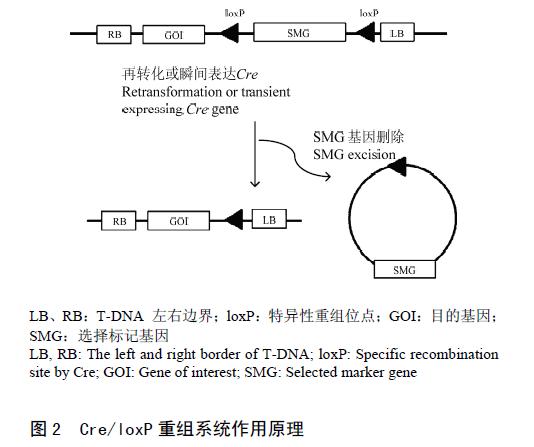
目前应用于标记基因删除的主要有:来自于噬菌体P1的Cre/loxP 重组系统、来自于酿酒酵母的FLP/FRT重组系统和来自于鲁氏酵母的R/RS 重组系统,其中,Cre、FLP 和R 为重组酶,loxP、FRT 和RS 为其特异性重组位点。
目前,应用较多的是Cre/loxP 重组系统,把Cre重组酶通过再转化引入转基因植株中或把重组酶Cre 的转化植株与loxP 转基因植株杂交,通过Cre在转基因植株中的表达激活重组系统,从而删除标记基因。但此法需要再转化或杂交,操作相对繁琐。此外,重组酶在转基因植株中的表达常引起植株表型的变异。为了解决这一问题,Gleave 等通过Cre重组酶在转基因烟草中的瞬时表达,实现了标记基因的删除,说明重组酶的瞬时表达也可删除标记基因,并避免了再转化和杂交过程。基于此原理,Kopertekh等构建了基于Potato Virus X 的PVX-Cre 载体,通过Cre 在烟草中的瞬时表达诱导重组,其重组率为42%—48%。
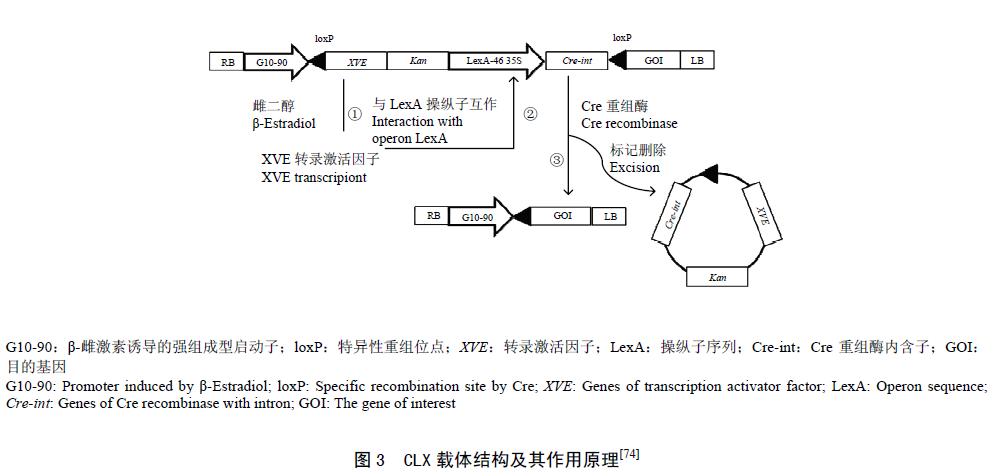
此外,Zuo 等构建了β-雌激素诱导的CLX 载体系统(图3),β-雌激素可激活启动子G10-90 诱导转录因子XVE 的表达,XVE 与LexA 操纵子作用激活Cre-int 的表达,诱导loxP 位点的重组,把位于两位点间的XVE、nptII 和Cre-int 切除掉,并使GFP 表达,该体系在拟南芥中已被验证有效。Luo 等发现Cre/loxP 和FLP/FRT 双重组系统的结合使用,可提高重组酶介导外源基因的删除效率。通过花粉或种子特异性启动子表达Cre 或FLP 重组酶,在T1 烟草种子中验证其删除率,平均删除率为33%—79%,部分植株中删除率可达100%。该技术为解决外源基因随花粉漂移或食用组织部分剔除目标基因提供了有效方法。然而,该技术需要分离受体植物花粉或种子中的特异性启动子,同时目的基因的删除将不利于转基因作物的制种和留种,因此,该法在转基因作物的研发和商业化应用中有一定的局限性。
2.3.2 基于位点特异性重组法的基因叠加技术 与Cre/loxP 、FLP/FRT 和R/RS 重组系统相对应,phiC31-att 和Bxb1-att 重组系统(phiC31 和Bxb1 为重组酶,att 为其对应的特定识别重组位点)称之为不可逆重组系统。与可逆重组系统识别位点相比,不可逆重组系统识别位点为非同源序列,即发生重组后产生的新位点与原来位点不会再发生重组。Ow基于此提出了可实现转基因植物中基因定点叠加的方法(图4),通过将连接有不可逆重组位点的可逆重组系统,引入基因组中,然后通过2 个不可逆重组位点的交替使用,可顺次引入外源基因,而可逆重组位点,可删除marker 基因和每次基因叠加时的非必须序列。另外利用该系统还可进行表达盒的定点替换、插入位点外源基因的删除和单拷贝植株的产生。Yau 等将此系统用于烟草的转化,成功实现了基因的定点整合,整合效率可达10%,并获得了无标记转化植株。利用该系统只要获得首轮转化时稳定表达的位点,以后就可通过定点整合把基因插入到该位点,实现基因的叠加或通过表达盒的交换引入新的基因,减少基因随机插入的盲目性。
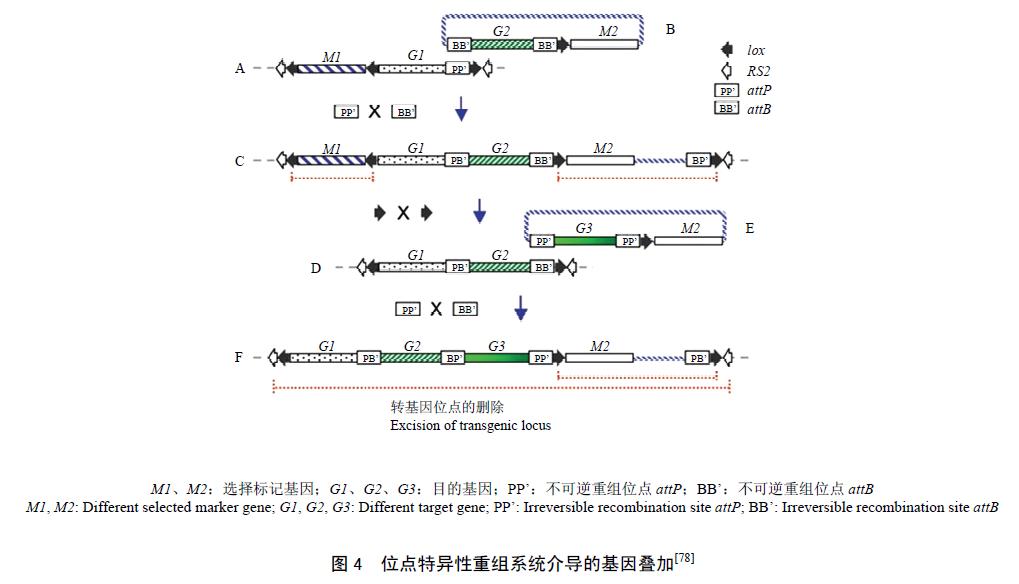
目前该技术仍处于研究阶段,还存在一些未知的影响因素,如基因的叠加对外源基因的表达是否有影响、基因间的调控元件对相邻基因的表达是否有影响、基因叠加过程中可能出现的基因沉默对后续基因叠加的影响,另外多轮转化时间漫长也是不可忽略的问题。
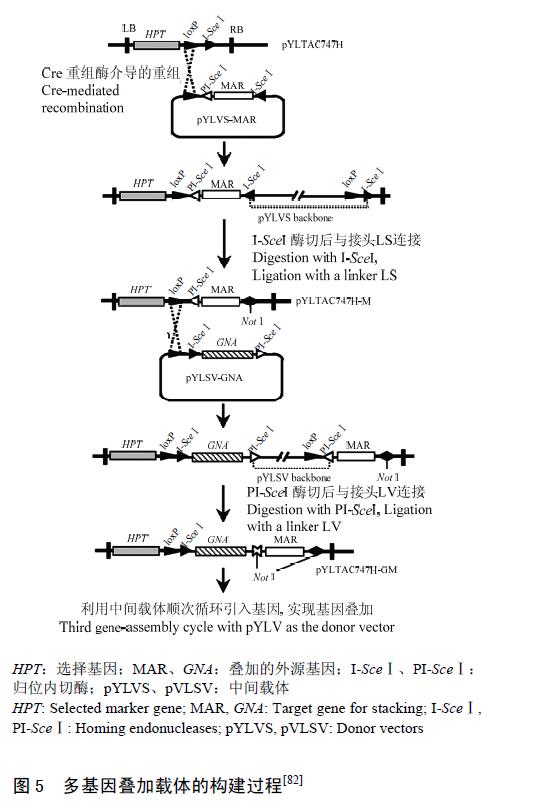
Lin 等基于位点特异性重组系统开发了可进行多基因叠加和传递大片段的载体系统,可有效解决Ow提出的基因定点叠加法可能出现的一些不利影响。该系统包括2 个过程,首先在大肠杆菌中构建多基因叠加的双元载体,然后把携带有多基因的表达载体导入农杆菌进行大片段的转化,创建多基因叠加的转基因植株。多基因表达载体的构建,是通过Cre/loxP重组系统介导的多轮重组和归位内切酶的多次切割和连接,交替把2 个中间载体中的外源基因顺次连接到目的载体TAC (TAC)中(图5),TAC 载体可以高效地传递大片段DNA。通过此系统作者构建了含10 个外源基因结构的TAC 表达载体,并成功转入水稻基因组中,除发现一个转水稻內源基因发生基因沉默外,其余基因都可共表达,并且把选择基因和目的基因分别置于2 个独立的T-DNA 中,以期通过后代的分离,获得无标记转化植株。该方法大大节省了基因叠加的时间,且体外基因叠加,减轻了多次转化进行叠加的工作量。
对于抗病、抗旱等植物复杂性状的改良,单个基因往往无法达到预期效果,位点特异性重组系统在基因叠加中展现出明显的优越性,不仅可缩短育种年限,加快多性状复合品种的产生,而且显著提高了转基因植物的安全性,有望成为未来植物转基因研究和安全转基因技术研发的重要技术之一。但目前的研究仅局限于烟草和水稻,尚需加强在其他重要农作物中的研究和利用。
2.4 转座子介导的标记基因删除技术
目前用于标记基因删除研究的转座子系统主要是来源于玉米的Ac/Ds 转座系统,删除策略主要有两种。一是把标记基因置于转座子内,与位于同一T-DNA内的目的基因共转化受体。在当代转基因植株中标记基因随转座子转位到别的位点,通过转基因植株子代的分离可获得无标记转化植株(图6)。Ebinuma 等基于此策略构建了ipt 标记基因的转座子系统(MAT),其中,ipt 位于Ac 转座子间,起一个双重功能正向选择功能和负向选择功能。在烟草和白杨转化试验中发现,无标记转化植株的获得率较低(0.032%),但Ac 转座频率可达5%。MAT 系统无需有性繁殖即可获得无标记转化的植株,适合于无性繁殖的植物。此外,在转基因植株中只存在目的基因,也是实现多基因累加的一种途径。
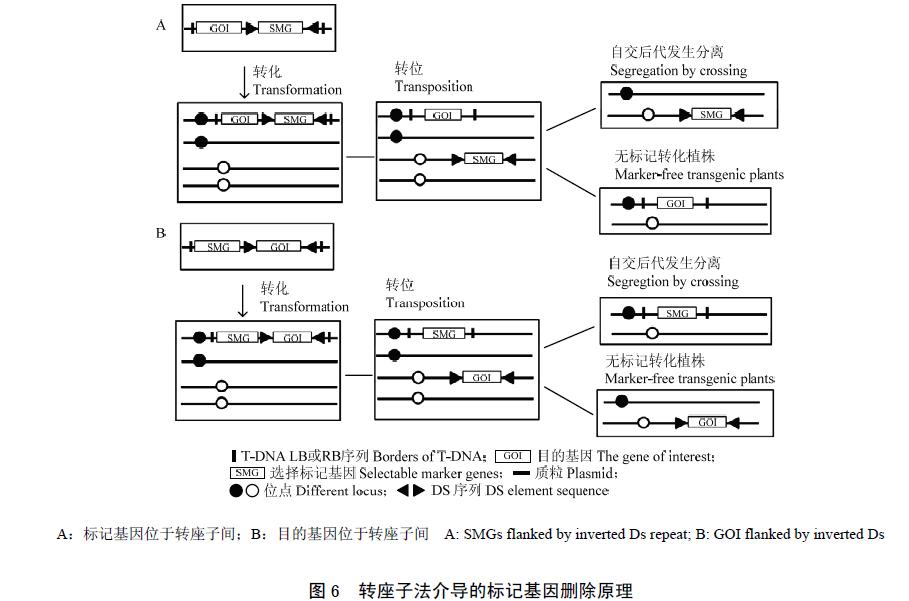
另一种策略是把目的基因置于转座子内,使目的基因随转座子转位到不连锁位点,通过转基因植株后代的分离获得无标记转化植株。此方法的优点是转化体不携带T-DNA 或其他非冗余序列,能产生“clean-gene”的插入。该方法最先应用于番茄转化,并获得了无标记转化植株。Cotsaftis 等用同样的方法,获得无选择标记的转cry1B 水稻,其转位频率为25%,同时证明cry1B 可高效表达,说明转位后的再插入对目的基因表达无影响。由于该方法删除选择标记是在转基因植株后代分离过程中完成的,因此,不适于无性繁殖的作物。
2.5 同源重组介导的标记基因删除技术
染色体同源序列间发生重组是自然界普遍存在的一种现象。同源重组会导致2 个同源序列间的片段发生倒置、互换、插入和缺失。如果重组发生在2 个同向的同源序列间,则同源序列间的片段就会被切除(图7)。Zubko 等把标记基因置于噬菌体附着位点attP的同向重复序列间,获得无标记转化烟草,同源重组频率达13.0%。attP 重组引发机制尚不清楚,但attP序列富含A+T 碱基,推测其与同源重组的引发相关,重组的形成可能是由双链断裂诱导引起的。
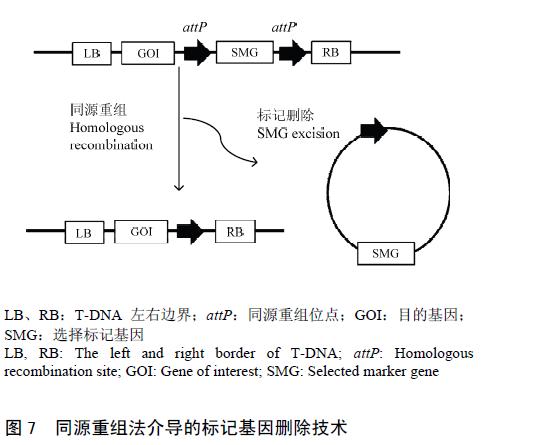
另外,Galliano 等研究发现,当把矮牵牛中的转化增强序列(TBS)置于attP 位点附近时,可提高其在矮牵牛、烟草、玉米中的同源重组频率。同源重组技术的优点是通过一步筛选即可得到无标记植株、无需再转化和有性杂交、无需蛋白酶的参与,但同源重组频率偏低是限制其应用的一个关键因素。总之,标记基因删除技术不仅消除了转基因植株中标记基因可能引起的潜在风险,同时也为创造多基因或多性状叠加的转基因植株提供了有利条件。随着技术的不断完善和发展,在重要农作物的转基因产品研发及产业化中必将发挥重要作用。
3 叶绿体转化技术
外源基因导入叶绿体基因组的方法主要有基因枪转化法、PEG 介导转化法、农杆菌介导转化法和显微注射法等,目前主要采用前两种方法。采取的主要策略有:(1)利用叶绿体特异启动子、终止子及5′-UTR 和3′-UTR 区序列实现目的基因在叶绿体的高效表达;(2)利用同源重组的方式,将外源基因特异重组到叶绿体基因组的特定位点;(3)利用筛选标记基因实现外源基因在叶绿体基因组中的同质化。1988 年,Boynton 等首次在低等植物衣澡实现基因的叶绿体转化。
1990 年,Svab 等利用基因枪法,将rrn16 导入到烟草叶绿体中,实现了高等植物叶绿体的基因转化。随后,叶绿体转化技术也成功应用于马铃薯、番茄和茄子等植物。叶绿体转化技术在禾本科作物中的应用较晚,直到2006 年,Lee 等才成功实现了水稻叶绿体的转化。目前,利用基因枪介导的叶绿体转化法已成功用于甘蓝、油菜、胡萝卜、棉花、大豆和白杨等。
叶绿体转化的优点是:(1)外源基因可高效表达,表达量可以达到核表达的几百倍;(2)可进行多基因的转化,并且适用于真核基因和原核基因的表达;(3)定点整合,无位置效应,不易产生基因沉默现象;(4)叶绿体为母系遗传,外源基因不会随花粉漂移。缺点是:(1)叶绿体基因组拷贝数高,同质化困难;(2)水稻、小麦及玉米等禾本科作物再生困难,前质体与叶绿体基因组的表达调控不同,外源基因的同源重组率太低,同质转化也较为困难。
4 基因拆分技术
基因拆分技术是为了降低基因漂移可能带来的环境风险而发展起来的一项新技术。基因拆分是建立在蛋白内含肽(Intein)及其介导的蛋白剪接基础上发展起来的。其作用原理为:将目的基因拆分成2 个基因片段,分别与Intein 两个剪接域的基因序列结合,形成融合基因。翻译后形成的2 个融合蛋白通过Intein介导的蛋白剪接,将Intein 自身从前体蛋白中切除,同时将外源基因片段编码的蛋白序列连接起来,形成一个完整的、有功能的蛋白(图8)。

目前研究较多的是来自集胞藻属(Synechocystis)的DnaE Intein(Ssp DNaE Intein),属于反式剪接Intein。2003 年,Chin 等和Yang 等首次证明了Intein 在植物中可正常行使作用。Chin 等将抗草甘膦基因EPSPS 拆分成两部分,其N端部分与Ssp DNaEIntein N 端融合形成EPSPSn-In,C-端部分和Ssp DNaEIntein C 端部分融合形成Ic-EPSPSc,通过农杆菌转化法将EPSPS-In 转入烟草核基因组中,利用同源重组法将Ic-EPSPSc 转入烟草叶绿体中,证明了无论Intein基因片段在叶绿体中表达还是被拆分在叶绿体和核基因组中表达,Intein 介导的剪接都能发生,且重组蛋白功能正常。Katja 等将来自芽孢杆菌的花粉不育基因( barnase ) 和来自水稻的乙酰乳酸合成酶(Acetolactate synthase)基因进行基因拆分,并在小麦中成功实现了两个基因的重组,获得了基因功能正常的转基因植株。目前,Intein 介导基因拆分技术还处于起步阶段,主要集中在模式植物如烟草、拟南芥中进行研究。由于Intein 介导的基因拆分技术需要通过杂交,获得目的基因正常表达的转基因后代,在杂种优势较强的水稻和玉米等作物利用前景更大,在杂种优势不明显的农作物中有一定的局限性。
5 植物基因定点修饰技术(打靶技术)
植物基因定点修饰是指外源DNA 片段与受体同源片段发生重组,使外源DNA 片段整合到染色体的预定位点(基因打靶)。与通常的基因敲除(如T-DNA标签、转座子标签及逆转座子标签)相比,植物基因定点修饰技术不仅能实现基因定点整合,而且可对靶基因进行精细改造(缺失或插入)。
5.1 锌指核酸酶介导的定点修饰技术
锌指核酸酶(ZFNs)是由一个DNA 识别域和一个非特异性的核酸内切酶组成的一种融合蛋白,广泛存在于动植物中。其中,DNA 识别域由一系列Cys2-His2 锌指蛋白(zinc-fingers)串联组成,识别一段特异的DNA 序列,与锌指蛋白相连的非特异性核酸内切酶是来自海床黄杆菌的一种限制性内切酶FokⅠ,该酶是一种type Ⅱ S 类的限制性内切酶,只有在形成二聚体时才具有酶切活性,可大大降低随机剪切的几率。ZFNs 转化细胞后,锌指蛋白特异性地结合识别位点,当两个锌指蛋白分子相距恰当距离时(6—8 bp),FokⅠ形成二聚体,恢复酶切活性,特异性地切断DNA,形成双链断裂缺口(DSB)。双链断裂可引起细胞内的DNA 损伤修复, 即非同源重组末端连接(NHEJ ) 和同源重组(HR)。NHEJ 修复机制可引起靶位点小片段的插入或缺失,从而引起基因的靶向敲除。当细胞中存在与靶位点同源的DNA 片段时,则细胞主要以同源重组的方式修复断裂的双链DNA,实现目标片段的定点整合(图9)。
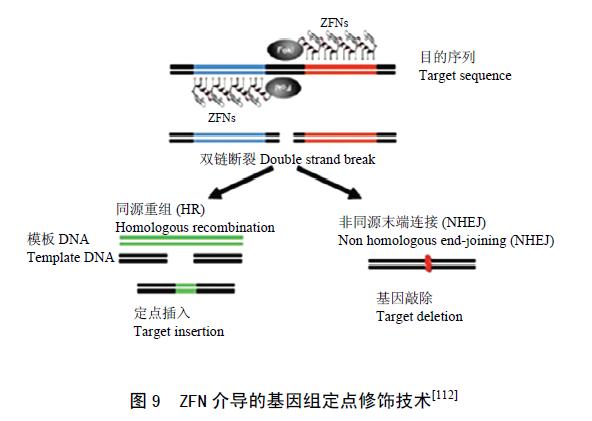
ZFNs 技术最早应用于果蝇的研究中,此后在斑马鱼、大鼠、小鼠等动物中用于基因定点突变研究。ZFNs 技术在植物中的研究起步较晚,目前主要用于模式植物中基因突变和修复研究。Lloyd 等把设计的ZFNs 基因与诱导启动子相连转入拟南芥,通过诱导启动子的活性,实现了基因定点突变,首次证明ZFNs 在植物细胞内具有正常功能,其非同源末端连接频率为7.9%。将ZFNs 用于烟草基因的定点修饰研究,结果显示其非同源末端连接频率约为2%,定点整合频率可达10%。Shukla 等把玉米肌醇激酶基因(IPK1)作为靶位点,筛选出2 对在基因第二外显子上特异结合的ZFNs,转化玉米后,实现了在IPK1基因第二外显子上的定点突变和小片段的插入。同时,实现了抗除草剂基因PAT 在IPK1 内的定点整合,其整合频率最高可达22%。然而作为一种新兴基因定点修饰工具,ZFNs 仍存在一些亟待解决的问题,如ZFNs的非特异性结合,即脱靶现象严重;ZFNs 对细胞的毒性和作用位点有限等。
5.2 TALEN 介导的基因组定点修饰技术
TALEN (TALENs)由TALE 蛋白和FokⅠ核酸内切酶的切割结构域人工融合而成,是最近几年发展起来的一种用于基因组定点修饰的分子工具。TALE 基因早在1989 年从Xanthomonas campestris pv. Veicatoria中被克隆,但TALE 蛋白的氨基酸序列与核酸特异识别序列的对应关系,直到2009 年才被破译。
TAL 的核酸识别单位为34 个重复氨基酸序列,其中的12、13 位点的氨基酸与A、G、C、T 有恒定的对应关系,即NG 识别T,HD 识别C,NI 识别A,NN识别G 或A。为获得识别某一特定核酸序列的TALE,只须按照DNA 序列将相应TAL 单元串联克隆即可。将识别特异序列的TALE 与非限制性内切核酸酶FokⅠ偶联后,便形成可定点剪切的内切酶TALENs,当转入细胞后便可在特定识别位点剪切形成双链断裂切口,诱发细胞内的DNA损伤修复( 图10)。TALEN技术已成功应用于酵母、线虫、人类细胞和斑马鱼的研究。
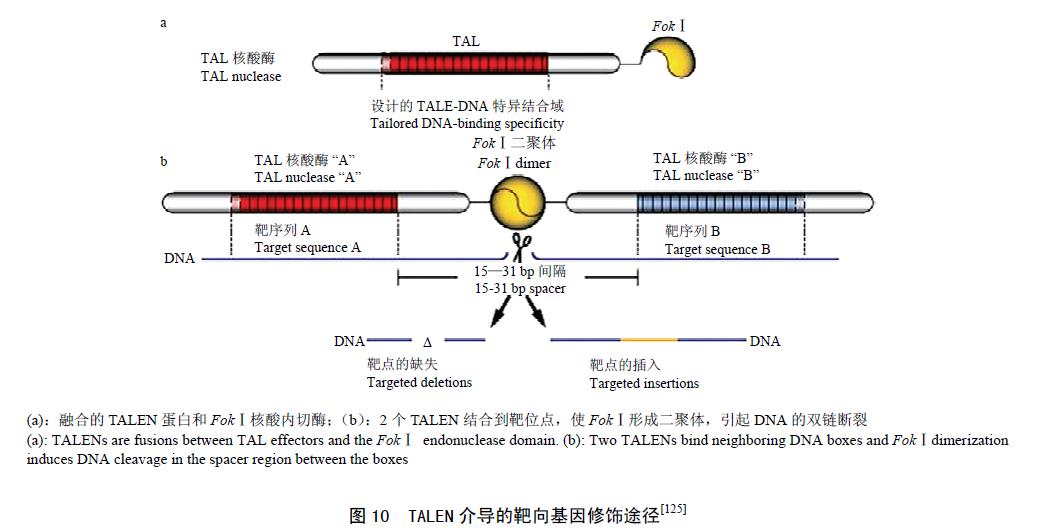
在植物研究中,Mahfouz 等将特异识别拟南芥RD29A 启动子区的dHax3 TALE 与EAR 转录抑制域(SRDX)偶联,构建了可定点抑制RD29A 转录的抑制子(dHax3.SRDX),并转化拟南芥, 发现dHax3.SRDX 蛋白可高效抑制RD29A::LUC 转基因拟南芥中LUC 的表达和拟南芥內源RD29A 的表达,说明TALEs 可用于植物靶向基因定点修饰研究,为植物基因功能研究提供了一个新的工具。Li 等利用TALENs 技术通过对水稻白叶枯病敏感基因Os11N3 的修饰,获得了稳定遗传的抗病植株,显示出TALENs 介导的基因定点修饰在作物遗传改良中具有重要应用前景。与ZFNs 技术相比,TALEN 定点修饰技术有以下优点:(1)TALE 便于设计和预测;(2)试验设计简单、准确、周期短、成本低;(3)毒性低、脱靶情况少等优点。
5.3 CRISPR/Cas9 系统介导的基因组定点编辑技术
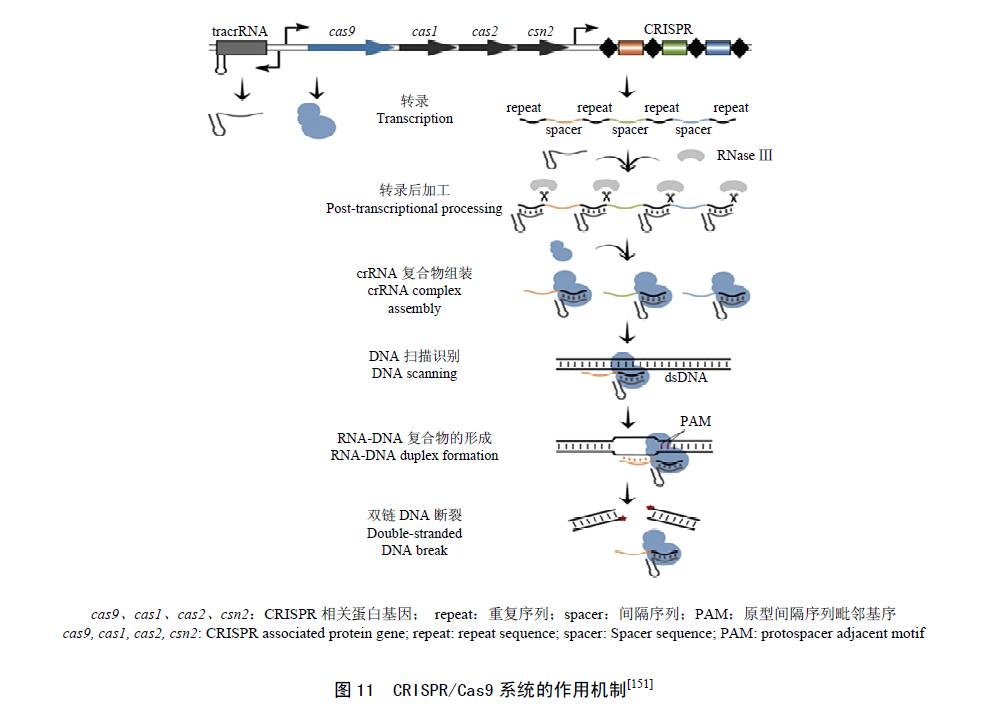
CRISPR/Cas(CRISPR/Cas)是广泛存在于细菌或古生菌中的一种获得性免疫系统。CRISPR 位点是位于细菌染色体上或质粒上的一段特异DNA 序列,由一系列短的高度保守的正向重复序列和与之长度相似的间隔序列(spacers)间隔排列组成。Cas 基因是与CRISPR 重复序列相连的保守的CRISPR 相关蛋白基因。根据Cas 基因核心元件序列的不同CRISPR/Cas 有3 种类型,其中,TypeⅡ型系统的核糖核蛋白复合物相对简单,包括crRNA(CRISPR RNAs)和tracrRNA(transactivating,crRNA)和一个Cas9 蛋白,是研究者主要研究的一个系统。Cas9 蛋白含有HLH 和RuvC-like两个核酸酶结域,是CRISPR/Cas9 免疫系统中的基本组成成分。当细菌受到噬菌体或外源质粒侵染时,CRISPR/Cas9 系统能够把外源DNA 的一段特定序列(protospacer)整合到其5 端的2 个重复序列间,当细菌再次受到侵染时, protospacer 会转录生成crRNAs,并与tracrRNA、Cas9 蛋白形成一种核糖核蛋白复合物,该复合物能够特异性地识别噬菌体DNA或质粒上的PAM(PAM)及protospacer 序列,然后Cas9 蛋白的2 个核酸酶结构域分别切割PAM 上游与crRNA 互补的DNA 区域,从而防止噬菌体的侵染和外来质粒的进入(图11)。
基于CRISPR/Cas9 系统的特异识别切割特点,将tracrRNA 和crRNA 形成嵌合RNA 分子,称为向导RNA(guide RNA,gRNA),CAS 蛋白在gRNA 的指导下,可对靶序列进行切割,引起DSBs,诱发细胞内的DNA 损伤修复(图12)。目前应用较为成功的是经过改造的来自产脓链球菌( Streptococcuspyogenes)的CRISPR/Cas9 系统。Jinek 等首次实现了基于CRISPR/Cas9 系统诱发的DNA 双链断裂,为CRISPR/Cas9 的进一步应用提供了基础。Cong 等首次利用CRISPR/Cas9 系统对人293T 细胞的EMX1和PVALB 以及小鼠Nero2A 细胞的Th 实现了定点突变,目前CRISPR/Cas9 技术已成功应用于大肠杆菌、肺炎双球菌、酿酒酵母、斑马鱼、果蝇、线虫、小鼠和大鼠中。
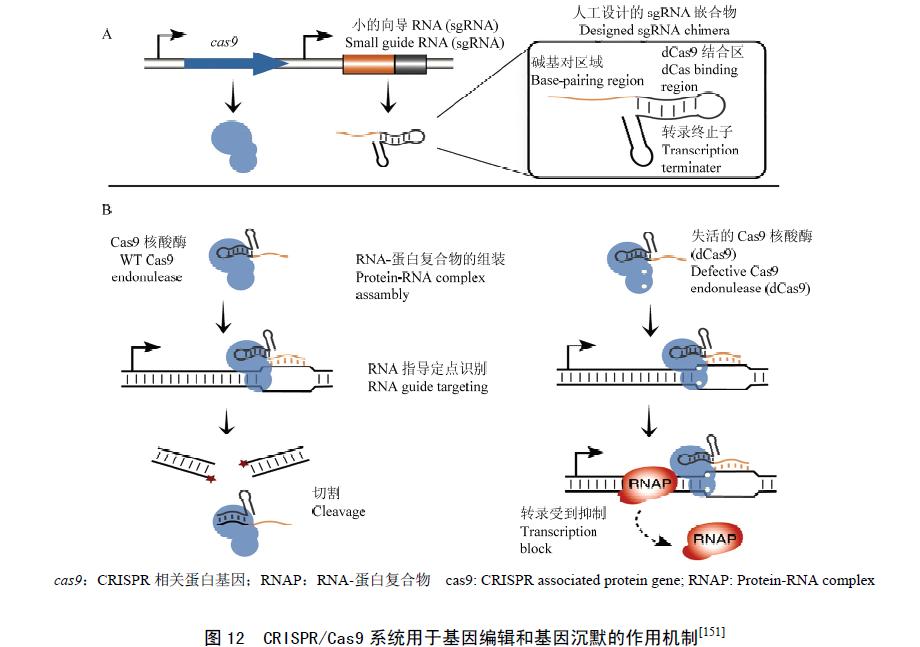
最近,CRISPR/Cas9 在植物中的应用也取得了重大突破,Nekrasov 等利用CRISPR/Cas9 系统成功实现了烟草基因PDS(phytoene desaturase)的定点突变,突变率为1.8%—2.4%,平均率为2.1%。Li 等利用CRISPR/Cas9 在拟南芥和烟草中也成功实现了基因组的定点突变,其突变率为1.1%—38.5%,并发现突变效率与gRNA 的表达量有关; 同时证明CRISPR/Cas9 系统可同时对多基因或单基因的多个位点进行定点编辑。Shan 等对水稻的OsPDS、OsBADH2、Os02g23823 和OsMPK2 4 个基因以及小麦TaMLO 实现了定点突变,在转基因水稻中的突变效率为7.1%—9.4%。此外CRISPR/Cas9 系统在基因表达调控上也展现出巨大应用前景。Lei 等把Cas9蛋白失活,使之失去核酸内切酶活性,然后通过在基因位点或基因转录位点设计靶位点,由于sgRNA 与靶位点的特异结合,导致基因在靶位点处转录受阻从而抑制基因的表达,利用此系统成功在大肠杆菌和人类细胞中实现了靶基因的沉默(图12)。
CRISPR/Cas9 系统是继ZFNs 和TALENs 技术之后出现的基因组定点编辑新技术。与ZFNs 和TALENs不同的是,CRISPR/Cas9 系统对靶位点的识别依赖于核酸之间碱基互补配对,可对任何紧随PAM(NGG)的20 bp 的靶点序列进行编辑,且其靶点在基因组中的分布频率很高,因此对于需要定点编辑的靶基因,更容易找到合适的靶位点;另外CRISPR/Cas9 系统可同时对同一基因的不同位点或多个基因的位点进行定向编辑,使其运用更加灵活;此外,CRISPR/Cas9系统操作简单快捷,每次打靶只需替换原有载体上20—30 bp 的核苷酸序列,更适宜规模化,高通量操作。
CRISPR 作为一种新的靶向基因修饰技术,目前已经应用于水稻、小麦、拟南芥以及本生烟基因的定点修饰研究中,但尚未有进行重要农作物目标农艺性状进行改良的研究。和TALENs 技术相比,其优点是试验设计更简单,但尚存在脱靶率较高的缺点。总之,CRISPR/Cas9 作为一种新的基因定向编辑技术,展现了广阔的发展潜力和应用前景,有望成为未来基因定向编辑的最强有力的工具之一。
6 展望
转基因作物商业化生产,产生了巨大的经济和社会效益,为解决全球不断增长的粮食需求和保障农业可持续发展发挥了重要作用。根据ISAAA 的统计报告,至2012 年,通过种植转基因作物,增加了农作物产量(价值982 亿美元),节省土地1.087 亿公顷,减少杀虫剂使用4.73 亿kg,有效保护了生态环境和生物多样性。为确保转基因作物产业化的健康发展,高效安全转基因技术的研发与应用具有重要意义。安全标记基因的开发和应用,可减少公众对抗生素或抗除草剂抗性标记基因可能带来的潜在风险的担扰。由于目前能够用于主要农作物上的安全标记基因并不多,开发新的标记基因,尤其是抗逆相关标记基因仍具有重要意义。
然而标记基因的存在,不利于基因的重复转化。利用标记基因删除技术不仅从根本上解决了标记基因的安全问题,而且还利于基因的重复转化。在上面所述的几种标记基因删除技术中,共转化法和位点特异性重组法展现出较大的应用前景。其中,共转化法是研究最早,也是比较成熟的一种方法,因其操作简单,而得到广泛的应用。位点特异重组法因其重组频率高、定点删除的特点,越来越受到重视。此外,位点特异性重组法介导的基因定点叠加技术,进一步拓展了标记基因删除技术的应用空间。总之,标记基因删除和外源基因累加技术仍在不断的发展和完善中,相信其在植物安全转基因研究中必将发挥越来越重要的作用。
此外,叶绿体转化法和基因拆分法,为限控转基因植物中基因漂移带来的潜在风险,提供了很好的途径。叶绿体是母系遗传,外源基因不会随花粉传播,造成基因漂移;基因拆分法,因为基因被分成两部分,这两部分同时漂移到近缘物种中的频率极低。因此,这在一定程度上降低了基因漂移的风险。但叶绿体转化法,因物种不同而转化效率具有较大差异,如禾本科植物小麦,水稻等较难转化。基因拆分技术目前还仅仅局限于模式植物的研究,在重要农作物中的应用,还需进一步研究。
转基因植物中,外源基因随机插入可能引起的负面作用如基因沉默和內源基因的突变,是研究者关注和需要解决的问题。基因定点修饰技术有望成为解决这一问题的有力工具。尤其是最近发展起来的TALEN和CRISPR/Cas9 技术,以其设计简单,高效易操作,成本低,靶位点分布广泛而得到迅速的发展。虽然目前基因定点修饰技术在植物中的应用还处于起步阶段,但相信基因定点修饰技术在植物研究中必将会有质的飞跃。

