单细胞测序技术概览(1)
前言
2013年,单细胞测序技术(single-cell sequencing)荣膺《自然-方法》年度技术。单细胞测序技术有助于我们剖析细胞的异质性。它可以揭示肿瘤细胞基因组中发生的突变及结构性变异,而这些突变和变异往往有着极高的突变率。有了这些信息,我们就可以描述肿瘤细胞的克隆结构,并追踪疾病的进展及扩散范围。本文将介绍2013年单细胞测序技术在人类早期发育、癌症以及神经科学研究等几个重点领域的最新应用成果。
1. 单细胞测序技术简介
本节将概述如何获得一个单细胞的基因组及转录组。
单细胞基因组及转录组测序所需要的测序样本量要比单细胞中本身所含有的基因组及转录组分子高出好多个数量级,所以这对核酸扩增技术(amplification technology)也是一大考验。面对如此微量的分子,任何降解、样品损失、或者污染都会对测序质量带来非常严重的影响。而且多重扩增又容易带来试验误差,比如基因组或转录组覆盖不均一、背景噪声以及定量不准确等问题。
最近所取得的技术进步有望部分解决上述问题,使单细胞测序技术能够走进更多的实验室,解决更多领域的科学问题。比较罕见的细胞、异质性的样本、与遗传嵌合或突变相关的表型、不能人工培养的微生物,这些都是单细胞测序技术能够一展所长的研究平台。使用单细胞测序技术能够发现克隆突变(clonal mutation)、隐藏的细胞类型,或者在大块组织样品研究工作中被“稀释”或平均掉的转录特征。
1.1 选择恰当的细胞
说到分离单细胞,显微操作(micromanipulation)无疑是一项非常精确的技术,而且利用毛细管(microcapillary)可以直接吸取细胞内容物,但是这项操作也需要耗费大量人力。很多组织解离之后都能够制成单细胞悬液,这种单细胞悬液很容易操作,而且可以用细胞分选器(cellsorter),根据细胞表面表达的特异性分子标志物对细胞进行分类富集操作。这种策略也被用来分离非常微量的循环肿瘤细胞。
1.2 单细胞转录组策略
现在有很多单细胞RNA测序操作流程可供选择,不过不管采用何种策略,首先都需要通过逆转录反应,利用RNA合成出cDNA。然后才会有所区别,比如有一些方法是对整个转录子进行测序,有一些方法只针对转录子的5\&\#39\;和3\&\#39\;端进行测序。不论采用何种方法,目的都只有一个,那就是捕获原始的RNA分子,然后均一的、准确地对其进行扩增。核酸的捕获效率主要受到逆转录反应的影响,不过我们可以使用更小的反应体系,选择更好的逆转录酶来进行改善。另外,采用模板转换技术(template switching)也能够保证被捕获的绝大部分转录子都是全长片段。减少反应循环数也能够改善核酸扩增反应,还可以借助“抑制PCR(suppression PCR)”技术减少引物扩增,或者将取自不同样品的cDNA(这些cDNA都是分别做好标记的)混合到一起,提高起始反应模板浓度,用体外转录技术进行线性扩增(linear amplification)。另外,还可以利用特有的分子识别序列(molecular identifier sequences)对每一个RNA分子进行标记,这样即便在经历了非均一的扩增之后,我们还是能够对原始的RNA分子数量进行绝对定量。
1.3 单细胞基因组策略
全基因组扩增(whol e-genome amplification)的起始反应产物更少,只有一个DNA分子。这样在扩增反应时就难免出现不均一的问题,即可能在基因组中某些位点会扩增多次,而另外一些位点则无法扩增。解决这个问题最常用的办法就是多重置换扩增技术(multiple displacement amplification, MDA),即使用随机引物,让这些引物与基因组广泛结合,同时使用一种特定的聚合酶,这种聚合酶能够置换与它自身附着在同一模板上的DNA链片段,形成一种反复分支结构(iterative branching structure),扩增出大段的DNA。早期循环对整个扩增反应的均一性起到了决定性作用。有一种扩增技术采用了一种独特的引物,这样能够生成闭合环状的扩增子(amplicon),而且这种扩增产物不会再进一步复制,等于是在进行PCR扩增反应之前先进行几轮线性扩增反应。将反应按比例扩大,同时对反应情况进行实时监控都有助于改善基因组扩增成功率低的问题,另外减少扩增次数,准备更少模板的测序文库也是一个比较值得发展的方向。
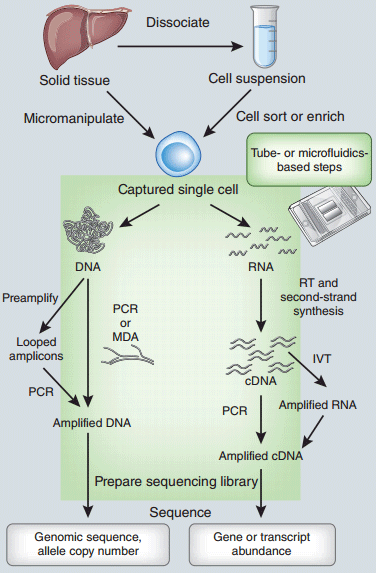
单细胞基因组或转录组扩增及测序工作流程图。
1.4 一个细胞解决所有问题
在单细胞研究工作中,扩大试验规模是确保采集足够多的生物多样性信息的关键。微流体设备(microfluidics)或微孔板技术(microwell technology)能够提供标准化、高通量的选择,而且由于这种设备的反应体积通常都比较小,所以反应效率也都比较高。不过微流体设备也有一定的限制,只能处理某些特定大小的细胞样品。当然,将待测分子用生物条码(barcoding)标记之后混合起来进行分析也是一条处理通量的途径。单细胞核酸扩增及测序技术正在不断成熟、完善之中。我们相信,随着单细胞试验操作变得越来越容易,成本变得越来越低,会有更多的科研人员选择使用单细胞测序技术,这将会像PCR技术一样成为每个实验室里的常规试验操作,帮助我们以更高的分辨率去研究问题、解决问题。
2. 单细胞测序技术——科研界主流关注的焦点技术
单细胞基因组测序技术及单细胞转录组测序技术又掀起了一波新的科研浪潮,让科研人员们能够以新的视角看待发育、肿瘤及神经科学问题。
对于不孕不育症夫妇而言,孕育一个孩子是非常困难的事情,而且这也会让他们的情感饱受折磨。即便他们怀孕了,也不是高枕无忧的,因为这些家长需要担心另外一个问题,如何生育一个健康的宝宝。对于那些存在遗传风险,需要借助体外受精技术(in vitro fertilization, IVF)辅助的父母而言,胚胎植入前遗传学诊断(preimplantation genetic diagnosis, PGD)技术(即从早期胚胎中取出一个细胞进行遗传学疾病筛查的技术)是孕育出健康下一代的保证,虽然目前PGD技术也只能够对基因组中的一个、或少数几个位点进行筛查和诊断。由于取自早期胚胎的细胞数量都不会太多,所以极其珍贵,临床医生们必须从这些宝贵的细胞中尽可能地获取有价值的信息。
而单细胞全基因组测序技术(single-cell whole genome sequencing method)就有望解决早期胚胎发育及其他科研领域里存在的这些重要的问题。由于单细胞分离技术以及单细胞中痕量的DNA或RNA扩增及测序技术的进步,科研人员们得以对单细胞的整个基因组或转录组(而不是少数几个位点)以前所未有的高分辨率进行扫描和研究。
美国哈佛大学(Harvard University)的Sunney Xie等人就是在IVF工作中进行单细胞基因组测序研究的课题组之一,他们用第一极体和第二极体(所谓极体指的是受精卵分裂时“遗弃”的细胞成分,可以反映染色体的健康状况)验证了他们新开发的全基因组扩增技术。Xie等人最近发表的文章介绍了他们对8位女性供体的研究成果,研究发现极体活检(polar-body biopsy)和单细胞测序都能够准确地反映胚胎染色体非整倍体(aneuploidy)的情况,其中就包括唐氏综合症(Down\&\#39\;s syndrome)这种染色体数目过多的情况,也包括染色体丢失,或者遗传自父母的单核酸突变(single-nucleotide variation)等情况(Cell, doi:10.1016/j.cell.2013.11.040 19 December 2013)。Xie发现染色体非整倍体平均只需要在每一百个基因组位点中挑出一个位点进行测序就足够了,所以这要比传统的方法成本更低,而且准确性也会更高。
Xie与这篇论文的合作者——中国北京大学(Peking University)的Fuchou Tang和中国北京大学附属第三医院(Peking University Third Hospital)的Jie Qiao针对这些接受IVF帮助的女性开展了一项临床研究。他们对这些志愿者的胚胎极体进行了基因组扩增和全基因组测序研究,以此来判断胚胎是否健康,是否适于进行移植、受孕。据Xie介绍,如果将时间提前两年,在临床上开展这项研究工作几乎是不可能的,当时有大批没有遗传问题,可是不能受孕的夫妻给他发邮件寻求帮助。目前这次临床研究的第一位婴儿将在年内降生。Xie指出,他并没有想到他们的技术能够这么快地走向临床,给患者们提供切实的帮助。”

Sunney Xie很快就能够看到他们课题组开发的基因组扩增技术被应用到临床PGD实际工作当中的表现情况了。
2.1 2013年测序技术回顾
单细胞测序技术可谓是科技发展史上的一大创举。一个细胞里的DNA或RNA仅仅处在皮克(picograms)级的水平,这么少的量远远达不到现有测序仪的最低上样需求。因此科学家们必须先对单细胞内的微量核酸分子进行扩增,而且必须保证尽可能少地出现技术误差,以便开展后续的测序及其他研究。直到最近,也还是只有少数几位专家相信能够对单细胞进行可靠的研究。
虽然早在几年前就开始有研究团体在宣传、推广单细胞基因组及转录组测序技术,但是这些技术是最近这两年才开始被大范围接受,其中就包括从事神经科学研究、肿瘤及微生物生态学研究的科研人员。据美国Fluidigm公司的联合创始人,斯坦福大学(Stanford University)的Stephen Quake介绍,几乎从PCR技术诞生的第一天开始,就不断有人尝试用PCR技术进行单细胞基因表达研究及单细胞基因组研究。但是由于种种原因,单细胞测序技术直到现在才算是刚刚起步。
DNA和RNA扩增技术的不断改进,尤其是最近这两年新出现的进步给刚刚涉足这个领域的科研人员在开展试验时提供了非常丰富的选择。工业界也提供了无数种商业化的、而且价格低廉的单细胞核酸扩增试剂盒及读取技术。Fluidigm公司就在2013年推出了世界上第一款单细胞RNA测序自动化准备系统(single-cell automated prep system for RNA-seq)。所有这些技术上的进步极大地降低了科研人员们进入单细胞研究这个领域的技术门槛。瑞典卡罗林斯卡研究院(Karolinska Institutet in Sweden)的Rickard Sandberg在谈到单细胞RNA测序时说道:“大家等这一天已经等了好几十年了。直到今天,由于技术的进步,这些试验才变得足够简单,而且成本也能够让大家接受,所以才能够走进千千万万个实验室。”
进行单细胞研究的核心问题其实是:为什么要进行单细胞研究?这主要是因为如果将成千上万个细胞混在一起进行研究,就会模糊我们对大脑、血液系统、免疫系统,及其组成这些系统的细胞之间异质性(heterogeneity)的认识。美国宾夕法尼亚大学(University of Pennsylvania)的James Eberwine就认为,当你的研究深入到单细胞层面时,你就会失去对整个系统的把控,但是如果你能够从整个系统中挑选多个不同的单细胞进行研究,则可以重建出整个系统,而且这种重建过程能够提供更多更有价值的信息。有大量很难对大块组织进行研究的科研领域也都会从这些最新的单细胞研究技术中获益。这种单细胞测序技术不仅有助于我们认识细胞之间的差异,还可以为我们提供一个新的比较层面,这也是大家期盼已久的,能够重新定义细胞类型的层面。
可与大家这种极高热情相伴的却是各种各样的技术难题,包括单细胞分离、基因组或转录组扩增,以及数据解读等各个方面。试验成本也是需要考虑的一大因素。通常来说,对细胞进行分析时所需要的细胞数量要比对组织进行分析时所需要的组织数量多很多,所以在决定是否应该进行单细胞研究时一定要谨慎,要根据实际情况做出合适的判断。“我们真的需要进行单细胞研究吗?如果答案是否定的,那就不要进行单细胞研究。单细胞研究非常贵,而且你会碰到很多的变数。”美国博大研究院(Broad Institute),同时也在麻省理工学院任职的Paul Blainey这样说道。
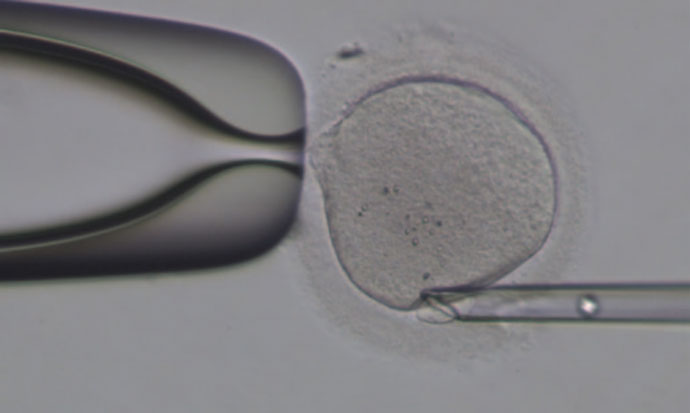
对体外受精卵分裂产生的极体进行基因组测序能够为临床医生们进行胚胎植入前的遗传学诊断和筛查提供非常有价值的帮助。
2.2 从少数几个RNA分子开始
对细胞的转录组进行测序,关键在于能否利用细胞内的RNA扩增出大量的cDNA。然而,捕获少量的RNA分子制备cDNA,以及大量扩增这些cDNA分子的工作很难做到平等和高效。
1990年,Norman Iscove的课题组首次证实对单细胞进行转录组分析是可行的,他们用 PCR技术实现了对cDNA分子的指数级扩增。在20世纪90年代初期,Eberwine等人发明了一种新技术,能够从单个的活神经元细胞中获得cDNA,并且再以这些cDNA为模板转录生成RNA,实现RNA的线性扩增。随着芯片时代的来临,科学家们用这些线性、和指数级扩增技术对单细胞之间的基因表达差异进行了大量的比较和研究。
2008年时出现了高通量RNA测序技术,不久之后,科研人员们就将这种技术与前面发展起来的核酸扩增技术结合起来,对单细胞转录组进行了更加精细的研究。2009年,当时在英国剑桥大学Gurdon研究所(Gurdon Institute at the University of Cambridge)M. Azim Surani实验室工作的Tang通过对单个小鼠卵裂细胞(blastomere)的研究发现,与芯片技术相比,利用单细胞转录组技术可以多发现数千个基因的表达情况(Nat. Methods 6, 377?382, 2009)。
就在同一年,美国冷泉港实验室(Cold Spring Harbor Laboratory)也召开了第一次单细胞大会,参加大会的有科研人员、技术开发人员,以及涉足单细胞研究领域的先驱们,参会者一共还不到50人。据现在在美国弗吉尼亚大学(University of Virginia)工作的Mike McConnell回忆,每一个人都试过做 RNA测序,也尝试过对测序结果进行分析,想从中找出有价值的、可重复的结论。
不过技术的发展经历了很长一段时间,现在终于有了一整套单细胞测序的操作流程和各种商业化的试剂盒产品。瑞典卡罗林斯卡研究院的Sten Linnarsson认为,纯粹技术上的发展到今年已经达到了顶点,现在是考虑如何将这些技术应用到实际工作当中。有很多课题组瞄准的可不是几百个细胞,他们想要研究上万个细胞。
比如 Kun Zhang课题组承担的、由美国国立卫生研究院公共资金(US National Institutes of Health Common Fund)资助的单细胞研究项目(Single Cell Analysis Program)就打算对取自人类大脑皮质三个不同区域里的10,000多个细胞进行全转录组分析。Zhang等人计划根据转录子对细胞类型进行分类(可能还会对细胞类型进行重新定义),并且将这些转录子重新定位到不同的大脑组织切片里。当然单细胞RNA测序这项技术本身已经不再是障碍了。据Zhang介绍,如果你有好的细胞,如果你想进行转录组研究,那么你会有很多种选择,帮助你达成目标。不过通常而言,如何在人死后提取神经元细胞,并尽可能减少RNA的降解,保持大脑组织正常的空间结构,这也都是需要解决的问题。 Zhang等人也在从事这方面的工作,正在对几种不同的技术进行比较。
2.3 基因组扩增技术
开发一项新的单细胞全基因组扩增技术是需要一定的时间的,这是因为在一个细胞内,通常都只有一至两个DNA的拷贝,所以直到2005年才出现单细胞全基因组扩增技术,这要远远落后于单细胞RNA扩增技术。当时Roger Lasken的团队成为世界上第一个成功完成单细胞DNA扩增及测序的团队,他们当时使用的是自己开发的多重置换扩增技术(multiple displacement amplification, MDA)对大肠杆菌进行试验。这项工作给微生物学家带来了极大的激励,他们利用这项技术对各种不能人工培养的微生物进行了测序研究,获得了大量的参考基因组序列(reference genome)。
MDA作为最常用的技术和策略一直沿用至今,该技术用到了Phi29等聚合酶,能够使经退火、结合到基因组上的任意随机引物不断延伸。每一种聚合酶都能够置换临近的延伸链,形成大量的、覆盖多个小片段的、长达7至10kb的大片段产物,用来进行DNA测序。
到了2011年,科研人员们将单细胞基因组扩增技术与高通量测序技术结合起来开展研究。Nicholas Navin当时就在美国冷泉港实验室的Michael Wigler课题组工作,他在取自两位乳腺癌患者的乳腺癌肿瘤细胞中发现了大段的基因组DNA缺失或重复突变,即拷贝数变异(copy-number variant, CNV),该研究的分辨率达到了50kb(Nature 472, 90?94,2011)。
在单细胞基因组测序工作中最大的困难就是某些DNA片段的扩增效率要远远高过另外一些DNA片段。Xie等人在2012年又发明了一种新的多重退火环状扩增循环技术(multiple annealing and looping-based amplification cycles, MALBAC),该技术首先需要进行5轮MDA预扩增,然后就可以使新获得的扩增产物形成闭合的环状分子(Science 338,1622?1626, 2012)。由于这些环状分子不能够被进一步扩增,所以整个扩增过程就变成了线性扩增。然后再进行常规的PCR扩增,由于此时采用的模板更加均一,所以在进行PCR扩增时就不易造成较大的差异。Xie等人用这种MALBAC技术获得的人类基因组扩增产物能够达到93%的覆盖度,同时也在单个肿瘤细胞中检出了CNV突变。
很快,科学家们就能够对单细胞的基因组进行更加深入的研究了,他们将能够发现更小的缺失和重复突变,乃至单碱基突变。虽然基因组均一扩增还是一个问题,但是专家们相信,缩小反应体积应该可以带来一定的帮助。
比如美国加州大学圣地亚哥分校(University of California, San Diego)的Zhang等人最近就介绍了一种MIDAS技术,即微孔板置换扩增系统(micro-well displacement amplification system),使用这套系统可以用纳升级的反应体系同时进行数千个MDA反应(Nat. Biotechnol., 31,1126?1132, 2013)。科研人员们可以手工、或者用机械手取出这些扩增产物,进行测序。借助这套MIDAS系统,Zhang等人课题组只进行了很少的测序工作就在人类神经元细胞中发现了单拷贝变异(single-copy-number change),分辨率达到了1至2MB。

这套MIDAS系统是一种高通量的单细胞分离、扩增及测序技术。
(未完待续)

