PNAS:转录因子ARF7晶体结构披露植物生长素信号的秘密
PNAS:转录因子ARF7晶体结构披露植物生长素信号的秘密
植物的叶片形状千变万化,有披针形、矛形、肾形、菱形、箭头形、卵形、圆形、勺形、心形、泪珠形、镰刀形等等。这些形状的生成取决于植物生长素的分配,而生长素决定着植物细胞分裂和伸长的速度。
为何一个简单的分子能够塑造如此复杂多变的形状呢?因为生长素能与大量控制基因表达的蛋白相互作用,施加自己的影响。近年来,人们发现了越来越多这样的蛋白,生长素的信号传导机制也越发复杂起来。现在,华盛顿大学的研究团队对生长素信号网络中的蛋白进行研究,找到了理解整个网络的关键所在。这项研究于三月二十四日发表在美国国家科学院院刊PNAS杂志上。
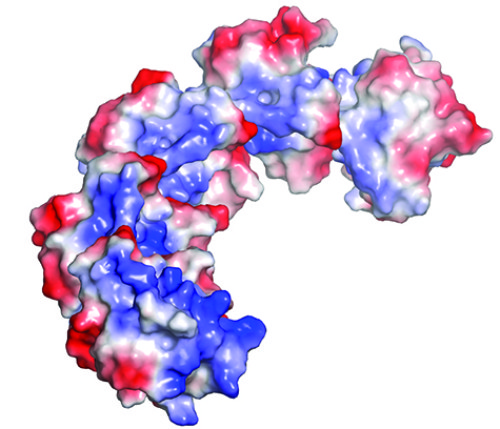
研究人员解析了一个关键转录因子的晶体结构。他们发现,该蛋白的互作区域折叠起来,形成分别带正负电荷的两面,就像一个磁铁。这样的结构区域允许蛋白相互吸引,形成长链或寡聚物。文章的资深作者,助理教授Lucia Strader指出,通过这些链的长度变化,植物可以精密调节不同细胞对生长素的应答,产生细微的结构差异。
塑造叶片形状只是植物生长素多种作用中的一个,其他还包括帮助植物向光源弯曲、根系向下生长、枝条向上生长、和果实发育等等。“吲哚3乙酸(IAA)是最强力的植物生长素,几乎涉及了植物生活史的方方面面,”Strader说。
在生长素及其影响的基因之间,涉及了大量的蛋白。研究人员指出,这些蛋白组合在每个细胞中都不同,整个系统相当复杂。为了进一步理解这一系统,文章的第一作者David A. Korasick获得了转录因子ARF7的晶体结构,该蛋白可帮助拟南芥向光源弯曲。
据介绍,此前的抑制子-转录因子互作模型已经建立了15年之久。人们一致认为抑制子平躺在转录因子上,抑制子的两个结构域分别与转录因子的两个结构域配对。而Korasick建立的结构模型显示,ARF7的两个结构域折叠在一起,形成像磁铁一样的互作区域。他们将这个拥有正电和负电两面的互作区域称为PB1结构域。据介绍,真菌、动物和植物都具有这样的结构域。
研究人员指出,同样拥有PB1结构域的抑制蛋白,可以与这种转录因子结合。研究显示,转录因子PB1结构域的两面必须各结合一个转录因子,才能够抑制生长素对它的影响。这就意味着,抑制蛋白与转录因子此前的一对一模型是错误的,Strader 说。“这样的相互作用不只局限在两个蛋白之间,可能涉及了数百个蛋白。”
例如,在Korasick的晶体结构中,五个ARF7的PB1结构域相互连接,形成了一个五聚体。“我把PB1结构域看成是磁铁,”Strader说。“它们能够前后颠倒着相连,形成长链。”
研究人员指出,随着植物的进化,生长素的信号传导系统变得越来越复杂。举例来说,与复杂的大豆相比,简单苔藓的信号传导蛋白就少得多。这说明生长素信号传导对植物相当重要,Korasick说。
“植物和动物的差异在于,”Strader说。“植物具有坚硬的细胞壁。当植物细胞决定分裂或伸长时,将是一个永久性的决定,因此需要极为严密的控制。”
原文摘要:
Molecular basis for AUXIN RESPONSE FACTOR protein interaction and the control of auxin response repression
David A. Korasick, Corey S. Westfall, Soon Goo Lee, Max H. Nanao, Renaud Dumas, Gretchen Hagen, Thomas J. Guilfoyle, Joseph M. Jez, and Lucia C. Strader
In plants, the AUXIN RESPONSE FACTOR (ARF) transcription factor family regulates gene expression in response to auxin. In the absence of auxin, ARF transcription factors are repressed by interaction with AUXIN/INDOLE 3-ACETIC ACID (Aux/IAA) proteins. Although the C termini of ARF and Aux/IAA proteins facilitate their homo- and heterooligomerization, the molecular basis for this interaction remained undefined. The crystal structure of the C-terminal interaction domain of Arabidopsis ARF7 reveals a Phox and Bem1p (PB1) domain that provides both positive and negative electrostatic interfaces for directional protein interaction. Mutation of interface residues in the ARF7 PB1 domain yields monomeric protein and abolishes interaction with both itself and IAA17. Expression of a stabilized Aux/IAA protein (i.e., IAA16) bearing PB1 mutations in Arabidopsis suggests a multimerization requirement for ARF protein repression, leading to a refined auxin-signaling model.
标签: 拟南芥 生长素信号 ARF7
作者:生物帮

