青岛能源所等提出P450单加氧酶与还原伴侣蛋白作用新机制
青岛能源所等提出P450单加氧酶与还原伴侣蛋白相互作用新机制
日前,由中国科学院青岛生物能源与过程研究所研究员李盛英主持,与美国密歇根大学、加州大学旧金山分校以及日本东邦大学等的多名学者合作首次提出了生物合成P450单加氧酶与还原伴侣蛋白相互作用新机制,相关成果已发表于最新一期的J. Am. Chem. Soc.。
P450单加氧酶能够高效、高选择性地催化种类繁多的复杂有机化合物的氧化反应,被誉为自然界的万能催化剂。而还原伴侣蛋白(redox partner protein)则在绝大多数P450的催化反应中不可或缺。传统观念认为:改变P450酶的还原伴侣虽然会影响其催化效率及产物分布,但不会改变催化反应类型,也不会因此产生新产物。基于该“常识”,在众多P450酶的酶学研究和工业应用中,常常借助一些非天然还原伴侣蛋白来替代其未知的天然还原伴侣发挥作用。
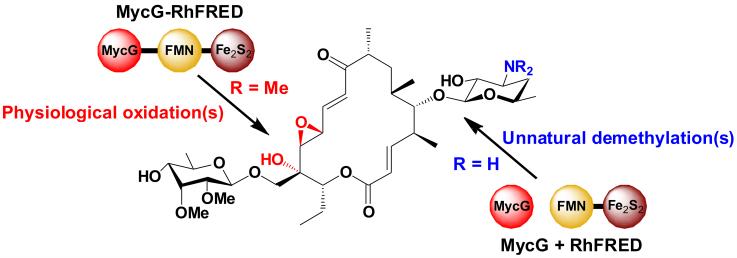
研究人员针对来源于稀有放线菌淡灰红小单孢菌(Micromonosporagriseorubida)大环内酯类抗生素麦新米星(mycinamicins)生物合成途径中P450单加氧酶MycG进行研究,首次对上述“常识”提出了挑战。在构建MycG与异源还原伴侣蛋白RhFRED的融合蛋白过程中,来自青岛能源所的张伟博士发现MycG与RhFRED处于融合或分离状态时,MycG以两种完全不同的方式对麦新米星结构进行修饰。在融合状态下,MycG催化麦新米星C14 位的羟基化和C12/13 位的环氧化;而在分离状态下,MycG不仅能催化羟基化和环氧化反应,还能针对不同底物催化全新的脱甲基反应,从而产生出7种全新结构的麦新米星衍生物。该发现使人们重新认识到还原蛋白在决定P450酶催化功能中的重要作用,揭示了一种通过改变P450与还原伴侣作用方式来产生新结构“天然产物”的全新方法。
上述研究得到了中组部 “青年千人计划” 、研究所“一二六”重点培育项目及国家自然科学基金面上项目(NSFC 31270855)支持。
论文信息:Zhang, W., Liu, Y., Yan, J., Cao, S., Bai, F., Yang, Y., Huang, S., Yao, L., Anzai, Y., Kato, F., Podust, L. M., Sherman, D. H.*, and Li, S.* New reactions and products resulting from alternative interactions between the P450 enzyme and redox partners. J. Am. Chem. Soc. 2014, 136: 3640-3646.

