Cell:德国科学家披露细胞在面临危险时是如何躲避的
德国马克斯·普朗克生物化学研究所和德累斯顿工业大学的研究人员通过广泛的综合性分析,研究了应激反应中的15 000种蛋白及其功能,揭示了应激反应中的新调控机制。这一成果有助于深入了解神经推行性疾病。相关文章发表于2014年2月27日的《Cell》杂志上。
Cell:德国科学家披露细胞在面临危险时是如何躲避的
在发生自然灾害之后(例如一场大火),辅助人员会迅速组织起来清理残骸,建立临时避难所为需要的人们提供食物。当细胞面临危险的环境条件时(例如高温或有毒物质),也会启动一个类似的程序——细胞应激反应,也称为热激反应。
当机体面临生命危险时,细胞的应急程序(热激反应)就会启动,不过“热激反应”这个名字带有一点误导性。二十世纪六十年代初期,人们在高温条件下首次观察到了细胞的应激反应。科学家将果蝇暴露在高温条件下,发现细胞为了自救启动了一个复杂的应急程序。虽然现在人们已经知道,这一程序也会被其他危险触发(例如辐射或有毒物质),不过这一名词仍然得以沿用。
细胞在热激反应中,合成了不同的应激蛋白。它们的任务是防止机体受到永久性的损伤。“你可以将其理解为一个紧急报警系统。为了尽快恢复到初始状态,这个系统会快速识别出现的问题和损伤,制定和调节应对措施,”Christian Loew博士说。研究人员通过广泛的综合性分析,研究了热激反应中的15 000种蛋白及其功能。他们向人们展示,根据不同的任务和受灾区域,辅助蛋白形成了不同的小组。例如,有一组蛋白专门负责核查细胞核中的DNA是否完整。
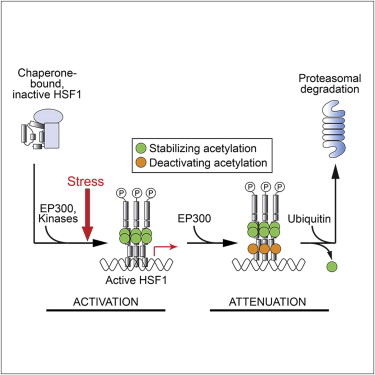
HSF1蛋白(热激转录因子)在细胞的救灾程序中起核心协调作用。一旦该蛋白激活,就会召集各种其他蛋白展开救助行动。研究人员通过RNA干涉,在HeLa细胞中筛查了应激反应中的调节蛋白,并描述了HSF1蛋白的两条调控路径。研究显示,当危机解除后,HSF1会被细胞的废物处理系统(蛋白酶体)降解。但只要还存在危险,另一个蛋白(乙酰转移酶EP300)就会阻止这种降解。
研究热激反应,可以帮助人们进一步理解阿尔茨海默症、帕金森症等神经退行性疾病。这些疾病中的细胞受到了巨大的损伤,这就对细胞的质控系统提出了更高的要求。一旦神经细胞死亡,就无法继续执行它们在大脑中的功能。“热激反应的定向激活可以减少特定的细胞损伤,”Loew解释道。
原文摘要:
Interplay of Acetyltransferase EP300 and the Proteasome System in Regulating Heat Shock Transcription Factor 1
Swasti Raychaudhuri,Christian Loew,Roman Körner,Stefan Pinkert,Mirko Theis,Manajit Hayer-Hartl,Frank Buchholz,F. Ulrich Hartl
When exposed to proteotoxic environmental conditions, mammalian cells activate the cytosolic stress response in order to restore protein homeostasis. A key feature of this response is the heat shock transcription factor 1 (HSF1)-dependent expression of molecular chaperones. Here, we describe the results of an RNA interference screen in HeLa cells to identify modulators of stress response induction and attenuation. The modulator proteins are localized in multiple cellular compartments, with chromatin modifiers and nuclear protein quality control playing a central regulatory role. We find that the acetyltransferase, EP300, controls the cellular level of activatable HSF1. This involves acetylation of HSF1 at multiple lysines not required for function and results in stabilization of HSF1 against proteasomal turnover. Acetylation of functionally critical lysines during stress serves to fine-tune HSF1 activation. Finally, the nuclear proteasome system functions in attenuating the stress response by degrading activated HSF1 in a manner linked with the clearance of misfolded proteins.
标签: 细胞应激 应激辅助蛋白 神经推行性疾病
作者:生物帮 点击:次

