PLOS Pathogens:病毒microRNA是诱发卡波济氏肉瘤关键因子
目前,美国德州大学圣安东尼奥分校(UTSA)和南加州大学(USC)的科研人员,首次确定了引起卡波济氏肉瘤(Kaposi's sarcoma)的病毒中的一个关键致癌成分。卡波济氏肉瘤是艾滋病感染者中最常见的恶性肿瘤。这为开发预防卡波济氏肉瘤和其他相关癌症的药物,奠定了基础。相关文章发表于2013年12月26日的《PLOS Pathogens》杂志上。
PLOS Pathogens:病毒micrornA是诱发卡波济氏肉瘤关键因子
本项研究的负责人、南加州大学Keck医学院分子微生物学和免疫学教授高守疆(S. J. Gao)博士说:“尽管已有二十年的深入研究,卡波济氏肉瘤相关的疱疹病毒(KSHV)如何使健康细胞变成恶性细胞,其背后的机制仍然没有得到很好的理解。这项研究首次证明,一种病毒因子,是KSHV诱导的恶性转化(malignant transformation)所必需的。我们已经确定了这些微小的病毒分子使健康细胞变成恶性细胞的机制。”
卡波济氏肉瘤又名多发性特发性出血性肉瘤,以皮肤上的黑色病灶为特征,感染KSHV的人最常发展为这种疾病,这种疾病也会损害免疫系统。尽管很多感染KSHV的人从来没有表现出任何症状,在艾滋病感染高发和艾滋病治疗有限的地区,卡波济氏肉瘤仍然是一个长期存在的问题。根据美国癌症协会的资料显示,在非洲的一些地区,90%以上的人口显示出KSHV感染的迹象。
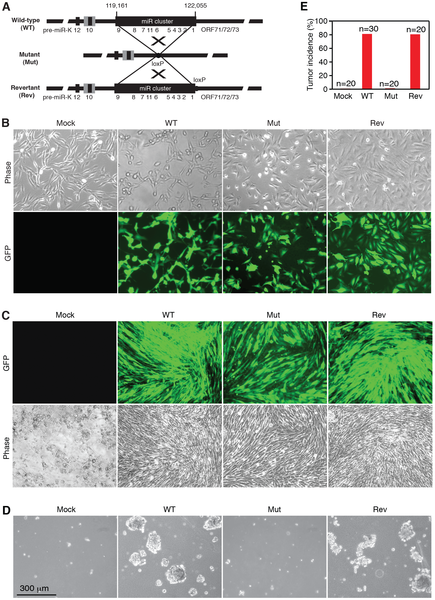
高守疆博士和来自德州大学圣安东尼奥分校、德州大学圣安东尼奥健康科学中心的同事们,利用他们在2012年构建的一个大鼠干细胞模型。在此之前,研究人员一直不能研究这种病毒,因为即便是最健康的细胞,一旦感染KSHV后,在变成癌细胞之前它们就会死亡。
在这项研究中,研究人员发现,一组病毒micrornA分子,是健康细胞转化为癌细胞所必需的。当这组microRNA分子被抑制后,细胞在感染KSHV之后,就会死亡。然而,扳动开关“打开”这个分子组,会使细胞仍然保持活动状态,并在感染病毒时变成恶性细胞。
采用先进的基因组学方法,研究人员还发现,microRNAs能够靶定IκBα蛋白和NF-κB细胞通路,这两者都与癌症的发展有关。
高博士还是USC Norris综合癌症中心的成员,他说:“我们的研究结果表明,这个KSHV micrornas组群及其调控的NF-κB通路,可能是KSHV相关癌症新疗法的潜在靶标。一些microRNAs似乎具有冗余的功能,因此靶定它们的常见通路,可能是一种更加可行的方法。在KSHV诱导的卡波济氏肉瘤模型中检验它们,应该是非常有趣的。”
原文摘要:
KSHV MicroRNAs Mediate Cellular Transformation and Tumorigenesis by Redundantly Targeting Cell Growth and Survival Pathways
Rosalie Moody, Ying Zhu, Yufei Huang, Xiaodong Cui, Tiffany Jones, Roble Bedolla, Xiufen Lei, Zhiqiang Bai, Shou-Jiang Gao
Kaposi's sarcoma-associated herpesvirus (KSHV) is causally linked to several human cancers, including Kaposi's sarcoma, primary effusion lymphoma and multicentric Castleman's disease, malignancies commonly found in HIV-infected patients. While KSHV encodes diverse functional products, its mechanism of oncogenesis remains unknown. In this study, we determined the roles KSHV microRNAs (miRs) in cellular transformation and tumorigenesis using a recently developed KSHV-induced cellular transformation system of primary rat mesenchymal precursor cells. A mutant with a cluster of 10 precursor miRs (pre-miRs) deleted failed to transform primary cells, and instead, caused cell cycle arrest and apoptosis. Remarkably, the oncogenicity of the mutant virus was fully restored by genetic complementation with the miR cluster or several individual pre-miRs, which rescued cell cycle progression and inhibited apoptosis in part by redundantly targeting IκBα and the NF-κB pathway. Genomic analysis identified common targets of KSHV miRs in diverse pathways with several cancer-related pathways preferentially targeted. These works define for the first time an essential viral determinant for KSHV-induced oncogenesis and identify NF-κB as a critical pathway targeted by the viral miRs. Our results illustrate a common theme of shared functions with hierarchical order among the KSHV miRs.

