薛定研究组在Cell Research 报道Cas9编辑线虫基因组技术新成果
2014年1月14日,清华大学生命学院薛定教授课题组在《自然》子刊Cell Research上发表学术论文“Oligonucleotide-based targeted gene editing in C. elegans via the CRISPR/Cas9 system” (寡聚核苷酸介导的CRISPR/Cas9靶向编辑秀丽隐杆线虫基因组技术)。该研究通过在线虫生殖腺中重新构建CRISPR/Cas9核糖核酸蛋白复合体,并首次使用商业化合成的寡聚核苷酸作为修复模板,实现线虫基因组的靶向基因定点突变。薛定教授为该论文的通讯作者,生命科学学院博士生赵培、张哲为本研究论文的共同第一作者。
基因组的靶向编辑,对于了解基因功能及其相关的基本生物学过程是至关重要。近一年来,CRISPR/Cas9介导的基因组编辑体系被广泛地应用于细胞系、小鼠、线虫及植物等多种模式系统来制造基因突变。然而,该课题组首次证明,商业化快速合成的寡聚核苷酸也可应用于线虫CRISPR/Cas9基因组编辑体系,并介导线虫基因组的精准靶向编辑。
该项研究通过显微注射的方式,在线虫生殖腺中表达CRISPR/Cas9 system 必需的Cas9和sgRNA。其中,sgRNA将识别基因组上位于NGG位点前的G/A(N)19序列,引导Cas9蛋白进行特异的基因组切割,并通过同时注射含有目标突变序列寡聚核苷酸作为模板,在基因组进行修复过程中引入目标突变。
该研究发现从未携带转基因标记质粒的线虫后代中,更容易筛选出基因编辑的突变体。这一发现对当前的筛选体系做出了重要的补充,也为寡聚核苷酸参与的Cas9/sgRNA介导的基因组定向编辑技术建立了更为完善的筛选条件。
通过这一研究体系,该研究组实现多个基因位点精准的定向突变。寡聚核苷酸介导的Cas9/sgRNA靶向编辑基因组技术的建立,将提供一个更为高效和精确的靶基因突变手段,对于构建基因突变体,了解基因功能、蛋白质基团作用,以及人类疾病相关保守蛋白功能研究等方面提供便利和有效手段。
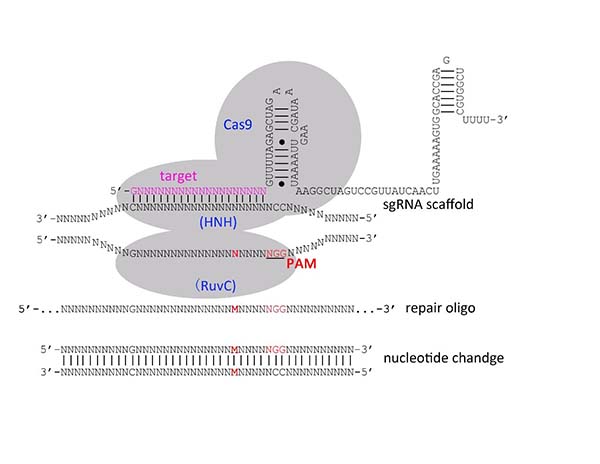
图示为寡聚核苷酸介导的CRISPR/Cas9靶向编辑线虫基因组技术示意图

