Cell:富含纤维的膳食有益于健康机制及肠道菌功能揭示
法国科学家证实,富含纤维的膳食与肠道菌群以及两餐之间肠道生成葡萄糖的能力有关。此外,他们还揭示了肠道以及它的相关菌群在维持血糖中所起的作用。这些研究结果将促成新的饮食建议来预防糖尿病及肥胖。相关文章发表于2014年1月9日的《Cell》杂志上。
Cell:富含纤维的膳食有益于健康机制及肠道菌功能揭示
在过去的二十年里,科学家们已经了解到富含纤维的膳食可以帮助生物体防止肥胖和糖尿病,但到目前为止仍不清楚相关的机制。现在由来自法国国家科学研究中心(CNRS)、法国国家医学与健康研究院(INSERM)和里昂第一大学等机构的研究人员组成的一个研究小组,成功地阐明了这一机制,证实其与肠道菌群以及两餐之间肠道生成葡萄糖的能力有关。此外,他们还揭示了肠道以及它的相关菌群在维持血糖中所起的作用。这些研究结果将促成新的饮食建议来预防糖尿病及肥胖。
大多数的甜果和许多的蔬菜,如婆罗门参、卷心菜或豆类都富含可发酵纤维。肠道无法直接消化这种纤维,而是转而由肠道细菌将其发酵为诸如丙酸酯和丁酸酯等短链氨基酸,才能被我们的身体所吸收。研究人员都知道这些纤维具有保护效应:食用富含纤维膳食的动物相比于食用无纤维膳食的动物具有更少的脂肪,不太可能形成糖尿病。然而,直到现在这一效应背后的机制仍是个谜。
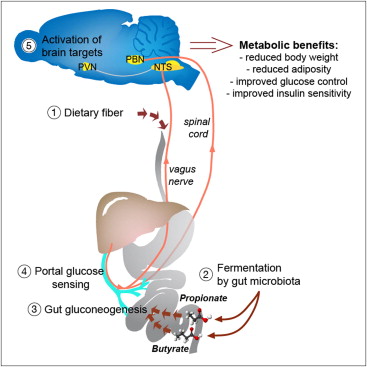
由法国国家科学研究中心Gilles Mithieux领导的这一研究小组,想知道这一机制是否可能与肠道生成葡萄糖的能力有关。在两餐之间以及夜间肠道能够合成葡萄糖并将它释放到血流中。葡萄糖具有一些独特的特性:当门静脉壁中的神经检测到葡萄糖时,会转而向大脑发送一种神经信号。作为应答,大脑会触发一系列对抗糖尿病和肥胖的保护效应:饥饿感消失、增加安静状态时的能量消耗,尤为重要的是,最终使得肝脏生成较少的葡萄糖。
为了确定可发酵纤维与肠道生成葡萄糖之间的联系,研究人员将大鼠和小鼠分为三组,分别给予富含可发酵纤维、富含丙酸酯,或富含丁酸酯的膳食。他们随后观察到这些饮食有强力地诱导了负责肠道葡萄糖合成的一些基因和酶表达。他们证实这些动物的肠道利用了丙酸酯作为前体促成了葡萄糖生成。喂给高脂和高糖饮食但同时补充纤维的小鼠相比于对照小鼠具有较少的脂肪,由于对胰岛素的敏感性显著增高也防止了糖尿病形成。
在重复实验中,研究人员采用遗传工程操作抑制了小鼠肠道生成葡萄糖的能力,随后未观察到保护效应:这些小鼠变得肥胖,像喂给无纤维膳食的小鼠一样形成了糖尿病。因此,肠道利用丙酸酯和丁酸酯来生成葡萄糖是可发酵纤维对生物体产生积极影响背后的机制。
新研究工作除揭示了这一从前未知的机制之外,还阐明了肠道菌群的作用:通过发酵膳食纤维,为肠道提供了生成葡萄糖的前体。它还证实了肠道在调控机体葡萄糖中的重要作用。最后,这些研究结果有可能促使提出一些新的营养指南,并揭示出一些可预防或治疗糖尿病及肥胖的新治疗靶点。
原文摘要:
Microbiota-Generated Metabolites Promote Metabolic Benefits via Gut-Brain Neural Circuits
Filipe De Vadder,Petia Kovatcheva-Datchary,Daisy Goncalves,Jennifer Vinera,Carine Zitoun,Adeline Duchampt,fredrik Bäckhed,Gilles Mithieux
Soluble dietary fibers promote metabolic benefits on body weight and glucose control, but underlying mechanisms are poorly understood. Recent evidence indicates that intestinal gluconeogenesis (IGN) has beneficial effects on glucose and energy homeostasis. Here, we show that the short-chain fatty acids (SCFAs) propionate and butyrate, which are generated by fermentation of soluble fiber by the gut microbiota, activate IGN via complementary mechanisms. Butyrate activates IGN gene expression through a cAMP-dependent mechanism, while propionate, itself a substrate of IGN, activates IGN gene expression via a gut-brain neural circuit involving the fatty acid receptor FFAR3. The metabolic benefits on body weight and glucose control induced by SCFAs or dietary fiber in normal mice are absent in mice deficient for IGN, despite similar modifications in gut microbiota composition. Thus, the regulation of IGN is necessary for the metabolic benefits associated with SCFAs and soluble fiber.

