大肠杆菌实验表明HipA基因通过休眠帮助细菌逃过抗生素追杀
纽卡斯尔大学的科学家发现,细菌的一个基因能够关闭自身的蛋白合成进入休眠状态,以便逃过抗生素的攻击。相关文章发表于《molecular Cell》杂志上。
大肠杆菌实验表明HipA基因通过休眠帮助细菌逃过抗生素追杀
上世纪四十年代人们发现,一群细菌中总有那么一两个,能够在抗生素的攻击下生存下来,这一现象被称为细菌的耐药性。细菌耐药性依赖于细胞的休眠,这一点与抗生素抗性并不相同,抗生素抗性是指细胞发生遗传学改变而对特定药物不敏感。细菌在休眠时会关闭正常的细胞功能,使抗生素丧失攻击目标,因为抗生素一般攻击活跃的过程(例如翻译或者转录)。
能够耐药的细菌一般拥有一对作用相反的蛋白——毒素和抗毒素。毒素会强迫细胞进入休眠状态,而抗毒素能逆转这种作用令细胞苏醒。HipA是首个在E. coli里鉴定到的毒素基因,它能够中止细菌的复制、转录和翻译过程。
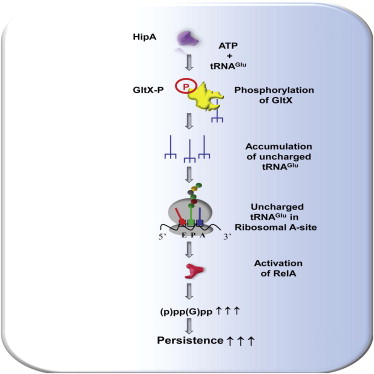
几年前,Richard Brennan及其同事发表文章指出,HipA能够使翻译因子EF-Tu磷酸化,通过抑制其活性中止蛋白的合成。不过纽卡斯尔大学的分子生物学家Nikolay Zenkin认为,这一机制还不能完全解释人们后来观察到的现象,例如HipA还能影响细胞的转录和复制。
Zenkin及其同事让细菌过表达多种基因,以寻找那些能够对抗HipA的基因。他们发现,即使在HipA存在的情况下,过表达gltx基因的细菌仍能很好地生长。研究显示,该基因的产物是谷氨酰trna合成酶(GltX),这种酶对于蛋白合成非常重要。
在蛋白的翻译过程中,GltX负责将谷氨酸添加到tRNA。研究人员指出,HipA过表达会导致GltX磷酸化,阻止它给tRNA添加氨基酸,使蛋白合成慢慢停止。“我相信GltX是HipA的作用目标,但我认为它并不是唯一的靶标,”未参与这项研究的Brennan评论道。
研究人员还指出,GltX不仅和EF-Tu一样能中止翻译过程,还能够阻断转录和复制。当GltX被HipA磷酸化时,空载的tRNA阻塞了核糖体,而核糖体负责在蛋白合成过程中转运氨基酸。这种tRNA造成的交通堵塞,会刺激细胞生成一种信号素(p)ppGpp。
“这一信号可以触发一系列级联事件,关闭细胞中的所有基础过程(例如复制、转录),使细胞进入休眠状态,”Zenkin说。为了验证这一点,研究人员去除了参与信号素合成的蛋白,发现这一措施的确能显著降低细菌的耐受性。
这一研究揭示了细菌的耐受性机制,但并没有提出抗生素的有效靶标。“问题在于E. coli有十二种毒素,甚至可能更多,”Zenkin说。“要解决细菌的耐受性,就得让它们全部失活。”
原文摘要:
Molecular Mechanism of Bacterial Persistence by HipA
Elsa Germain,Daniel Castro-Roa,Nikolay Zenkin,Kenn Gerdes
HipA of Escherichia coli is a eukaryote-like serine-threonine kinase that inhibits cell growth and induces persistence (multidrug tolerance). Previously, it was proposed that HipA inhibits cell growth by the phosphorylation of the essential translation factor EF-Tu. Here, we provide evidence that EF-Tu is not a target of HipA. Instead, a genetic screen reveals that the overexpression of glutamyl-tRNA synthetase (GltX) suppresses the toxicity of HipA. We show that HipA phosphorylates conserved Ser239 near the active center of GltX and inhibits aminoacylation, a unique example of an aminoacyl-tRNA synthetase being inhibited by a toxin encoded by a toxin-antitoxin locus. HipA only phosphorylates tRNAGlu-bound GltX, which is consistent with the earlier finding that the regulatory motif containing Ser239changes configuration upon tRNA binding. These results indicate that HipA mediates persistence by the generation of “hungry” codons at the ribosomal A site that trigger the synthesis of (p)ppGpp, a hypothesis that we verify experimentally.

