生命中心葛亮团队揭示非经典分泌蛋白进入膜泡的分子机制
生命中心葛亮团队揭示非经典分泌蛋白进入膜泡的分子机制
蛋白质分泌是细胞之间进行信息传递的核心方式之一。我们通常所指的分泌蛋白具有N端的信号肽序列,能够被信号识别颗粒(SRP)所识别并通过SEC61转运体(translocon)进入内质网腔,随后信号肽被切除,分泌蛋白经过加工和修饰,通过内质网-高尔基体(ER-Golgi)膜泡运输途径被运送到细胞外,该过程被称为经典分泌途径【1-3】,其关键内容已经被写入细胞生物学教科书。 近年来研究发现,许多蛋白质的分泌不依赖于ER-Golgi的常规分泌途径,称为非经典分泌(Unconventional Protein Secretion, UPS)【4,5】。大多数UPS蛋白不具有典型的信号肽,其分泌主要通过两种方式:(1)直接穿越细胞质膜(I型)【6,7】; (2)类似于经典分泌,需要膜泡运输介导(III型)【8,9】。在III型UPS中,蛋白质需要进入一个膜泡载体(例如分泌性自噬体和溶酶体等),然后通过膜泡运输系统被运送到细胞外。由于缺少信号肽的导向,一个亟待解决的关键问题就是这类UPS货物是如何进入膜泡载体中的。 2020年4月8日,生命中心葛亮课题组在Cell杂志在线发表题为“A translocation pathway for vesicle -mediated unconventional protein secretion”的研究论文,报道了一条介导UPS货物进入膜泡的蛋白跨膜转运分子通路。

促炎症因子IL-1β (interleukin-1β)是第一个被发现,同时也是研究最多的非经典分泌蛋白【10】。IL-1β可通过I型和III型UPS分泌:I型途径中,IL-1β主要通过Gasdermin D(GSDMD)N末端片段在细胞质膜上形成的孔被释放【11-13】;III型途径中,成熟型IL-1β (mIL-1β)被会运送到一个膜泡载体中【14-18】。在之前的研究工作中,作者建立了一套分析mIL-1β分泌的细胞学系统,发现mIL-1β能够转运进一个中间膜泡结构并进入自噬体的双层膜结构之间,最终通过分泌型自噬被分泌到胞外,并且这一跨膜转运过程依赖于蛋白质的去折叠【17】,这预示着存在一个类似translocon的膜通道(图1)。
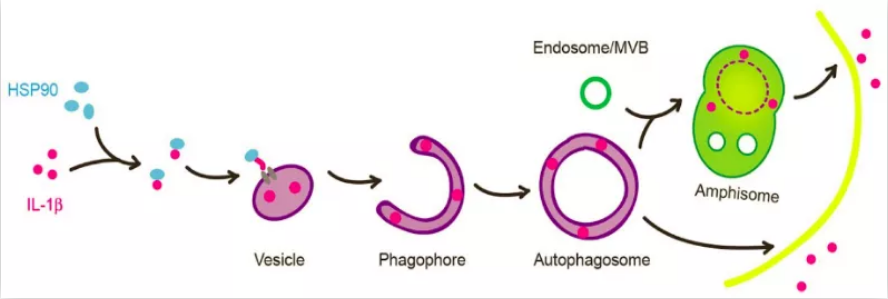
图1. IL-1β进入膜泡载体并通过分泌型自噬被分泌
该工作中作者为鉴定这个未知的通道蛋白,采用二氢叶酸还原酶(DHFR)系统,并结合了蛋白质交联和质谱技术。由于氨基蝶呤(aminopterin)抑制DHFR的去折叠,折叠形式的DHFR会像塞子一样将mIL-1β-flag-DHFR阻滞在膜转运机器上。之后通过化学交联与免疫沉淀富集转运机器并通过质谱进行鉴定,找到了一个膜蛋白TMED10(图2)。细胞学研究发现TMED10调控mIL-1β的分泌。在CLP诱导的败血性休克(Cecal Ligation and Puncture (CLP)-induced septic shock)小鼠模型中,TMED10髓系敲除的小鼠分泌更少的mIL-1β, 进而导致更低的炎症反应与更高的存活率,提示TMED10在某些生理条件下调控炎症因子的释放和炎症反应。
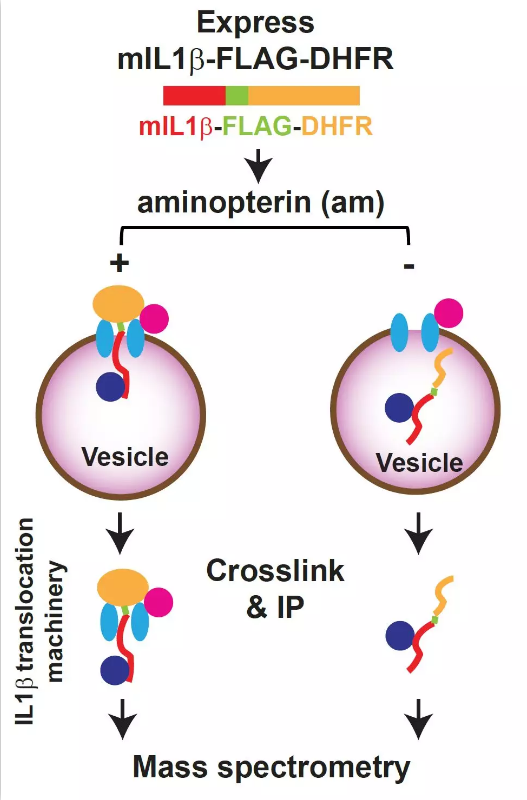
图2. 鉴定未知转运体策略
有趣的是除了IL-1β外,非经典分泌蛋白IL-1家族其它成员(包括:IL-1α、IL-18、IL-33、IL-36、IL-37和IL-38)以及分子伴侣(HSP5B)、糖链结合蛋白(galectin 1和galectin 3)、 磷脂结合蛋白(Annexin A1)和神经毒性蛋白(Tau)的分泌也受TMED10调控,提示TMED10调控一系列UPS蛋白货物的分泌。鉴于多种非经典分泌蛋白直接受TMED10的调控,一个重要的问题是否存在一个类似于经典分泌信号肽的共同序列调节这些UPS货物的分泌?通过序列比对,作者发现了一个共同的基序motif1对这些UPS蛋白的分泌不可或缺, 提示motif1可能是一个通用的TMED10介导的非经典分泌信号序列。 为了研究TMED10是否是个蛋白转运体,作者建立了体外脂质体重建实验系统,发现UPS货物能够转运进入含有TMED10的蛋白脂质体,并且转运过程依赖于UPS货物的motif1和蛋白质去折叠。这提示TMED10具有直接转运UPS货物进入膜泡的活性,可能是一个通道蛋白。除此之外,作者也发现分别位于细胞质和内质网腔内的两个分子伴侣蛋白HSP90A和HSP90B1(GRP94)促进TMED10介导的蛋白跨膜转运,提示TMED10和这两个膜泡内外分子伴侣蛋白协同转运UPS货物进入膜泡。 免疫荧光和电镜结果显示UPS货物与TMED10在细胞内共定位于ERGIC (ER-Golgi intermediate compartment)。双分子荧光互补(Bimolecular Fluorescent Complimentary, BiFC) 实验显示TMED10与mIL-1β处于相同的膜泡结构。这些结果表明,TMED10可能通过在ERGIC上形成一个通道介导UPS货物进入膜泡载体ERGIC。 然而,TMED10是一个单次跨膜蛋白,要形成通道,就需要发生寡聚化。作者发现UPS货物大量产生时导致TMED10自身发生寡居化,而随着分泌的完成TMED10寡聚体逐渐解聚。这提示TMED10转运体的形成和其介导的UPS货物分泌是一个受货物调节的过程,在货物大量产生的时候被激活。 基于以上的实验结果,作者提出了一个TMED10介导的非经典分泌途径模型并命名为THUPS (TMED10-channeled UPS):当需要分泌的UPS货物(例如炎症反应中大量产生的mIL-1β)大量产生时,将激活THUPS非经典分泌途径,UPS货物结合分子伴侣HSP90A发生去折叠,结合ERGIC上的TMED10,诱导其发生寡聚化形成蛋白转运体,在腔内分子伴侣HSP90B1的帮助下进入ERGIC这一膜泡载体。作者先前的研究发现ERGIC是自噬体的重要膜来源【19】。鉴于分泌型自噬参与UPS,ERGIC可能是分泌性自噬的一个源头细胞器。UPS货物将通过ERGIC进入分泌性自噬的过程以及下游膜泡通路(包括:分泌性溶酶体和多泡体(MVB)等),最终被运送到细胞外。当然也不排除ERGIC上产生的膜泡也可以通过其它途径将UPS货物分泌到细胞外(图3)。
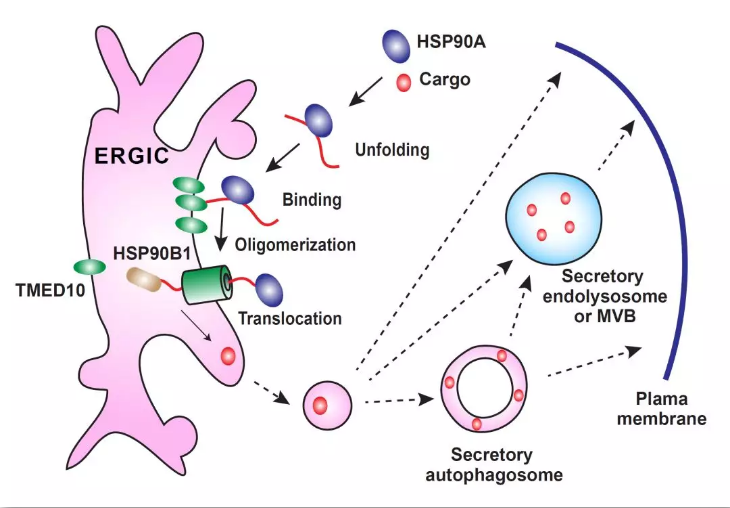
图3. TMED10介导的蛋白质非经典分泌途径工作模型
该研究提示类似于经典分泌途径,非经典蛋白质分泌也存在一条(或者多条)蛋白质跨膜转运通路调节蛋白的分泌。在细胞内THUPS可能是SEC61介导的经典分泌跨膜转运的平行途径,调节非经典蛋白质分泌。该研究还处于初期,很多问题还需要进一步解答,包括:该通路的分子细节、THUPS相关非经典蛋白质分泌组以及生理意义等。
据悉,这项研究由生命中心葛亮实验室完成,实验室张敏博士和博士生刘磊是文章的共同第一作者,葛亮研究员为通讯作者。
附清华大学葛亮实验室博后招聘信息:
清华大学生命科学学院/生命科学联合中心葛亮实验室主要利用分子细胞生物学、生物化学和小鼠模型等手段研究细胞自噬以及新发现的非经典蛋白质分泌的分子机制、组织稳态平衡、炎症反应以及代谢相关疾病。计划招聘博士后1-2名。我们鼓励各学科方向有科研理想,充满工作热情的同学加入我们研究团队,并给与各方面大力支持。对癌症、代谢和神经退行疾病有研究经验的应届博士毕业生我们会优先考虑。
申请方式:有意申请者请将本人简历(附照片)、研究工作经历、及其它能证明科研能力的相关电子文件,和2-3位推荐人的姓名和联系方式,发送至:liangge@mail.tsinghua.edu.cn。请在邮件标题中注明“博士后申请”。合适者,将尽快安排面试。
原文链接:
https://doi.org/10.1016/j.cell.2020.03.031
参考文献:
1.S. O. Shan, P. Walter, Co-translational protein targeting by the signal recognition particle. FEBS Lett 579, 921-926 (2005).
2.G. Zanetti, K. B. Pahuja, S. Studer, S. Shim, R. Schekman, COPII and the regulation of protein sorting in mammals. Nat Cell Biol 14, 20-28 (2011).
3.T. A. Rapoport, L. Li, E. Park, Structural and Mechanistic Insights into Protein Translocation. Annu Rev Cell Dev Biol 33, 369-390 (2017).
4.W. Nickel, C. Rabouille, Mechanisms of regulated unconventional protein secretion. Nat Rev Mol Cell Biol 10, 148-155 (2009).
5.C. Rabouille, V. Malhotra, W. Nickel, Diversity in unconventional protein secretion. J Cell Sci 125, 5251-5255 (2012).
6.J. P. Steringer, W. Nickel, A direct gateway into the extracellular space: Unconventional secretion of FGF2 through self-sustained plasma membrane pores. Semin Cell Dev Biol 83, 3-7 (2018).
7.T. Schafer et al., Unconventional secretion of fibroblast growth factor 2 is mediated by direct translocation across the plasma membrane of mammalian cells. J Biol Chem 279, 6244-6251 (2004).
8.V. Malhotra, Unconventional protein secretion: an evolving mechanism. EMBO J 32, 1660-1664 (2013).
9.J. M. Duran, C. Anjard, C. Stefan, W. F. Loomis, V. Malhotra, Unconventional secretion of Acb1 is mediated by autophagosomes. J Cell Biol 188, 527-536 (2010).
10.A. Rubartelli, F. Cozzolino, M. Talio, R. Sitia, A novel secretory pathway for interleukin-1 beta, a protein lacking a signal sequence. EMBO J 9, 1503-1510 (1990).
11.N. Kayagaki et al., Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature 526, 666-671 (2015).
12.J. Shi et al., Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature 526, 660-665 (2015).
13.C. L. Evavold et al., The Pore-Forming Protein Gasdermin D Regulates Interleukin-1 Secretion from Living Macrophages. Immunity 48, 35-44 e36 (2018).
14.G. Schatz, B. Dobberstein, Common principles of protein translocation across membranes. Science 271, 1519-1526 (1996).
15.P. A. Verhoef, M. Estacion, W. Schilling, G. R. Dubyak, P2X7 receptor-dependent blebbing and the activation of Rho-effector kinases, caspases, and IL-1 beta release. J Immunol 170, 5728-5738 (2003).
16.N. Dupont et al., Autophagy-based unconventional secretory pathway for extracellular delivery of IL-1beta. EMBO J 30, 4701-4711 (2011).
17.M. Zhang, S. J. Kenny, L. Ge, K. Xu, R. Schekman, Translocation of interleukin-1beta into a vesicle intermediate in autophagy-mediated secretion. Elife 4, (2015).
18.C. Semino, S. Carta, M. Gattorno, R. Sitia, A. Rubartelli, Progressive waves of IL-1beta release by primary human monocytes via sequential activation of vesicular and gasdermin D-mediated secretory pathways. Cell death & disease 9, 1088 (2018).
19.L. Ge, D. Melville, M. Zhang, R. Schekman, The ER-Golgi intermediate compartment is a key membrane source for the LC3 lipidation step of autophagosome biogenesis. Elife 2, e00947 (2013).


