我校在植物病原真菌糖基化修饰研究方面取得新进展
南湖新闻网讯(通讯员 刘彩云)近日,我校植物科学技术学院陈小林课题组与合作者在国际学术期刊PLOS Pathogens和Environmental Microbiology分别发表研究论文,研究报道了植物病原真菌N糖基化修饰和GPI锚定修饰两种糖基化修饰的最新进展。
糖基化修饰是细胞中最普遍存在的蛋白修饰类型,包括N糖基化修饰,O糖基化修饰以及GPI锚定修饰等三种主要类型。这些糖基化修饰在调控蛋白稳定性,蛋白折叠,蛋白分泌运输,蛋白互作以及识别等过程发挥重要作用。尽管糖基化修饰在生命过程中非常重要,但其在植物病原真菌致病过程中的功能却远未得到足够的认识。
2月24日,国际学术期刊PLOS Pathogens在线发表了华中农业大学植物科学技术学院陈小林课题组与中国农科院植物保护研究所刘文德研究员合作的题为“Quantitative proteomics analysis reveals important roles of N-glycosylation on ER quality control system for development and pathogenesis in Magnaporthe oryzae”的研究论文,该研究采用定量蛋白质组学技术,系统鉴定了稻瘟病菌N-糖基化修饰靶标蛋白,发现N-糖基化修饰可通过靶标蛋白协调稻瘟菌不同发育和致病过程,同时揭示了N-糖基化修饰通过调控内质网质量控制系统(ERQC)参与致病过程的分子机制。
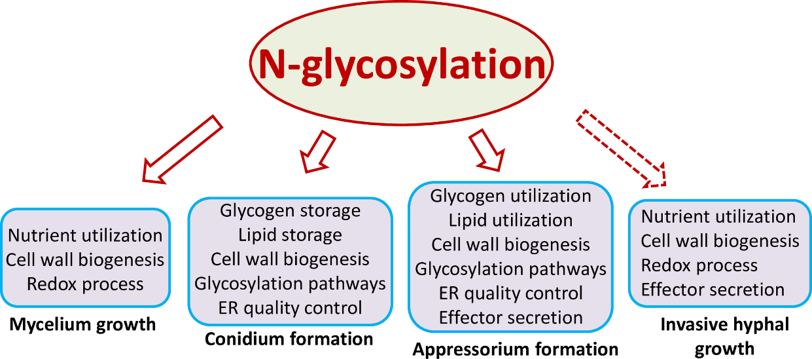
图1 N糖基化修饰协调稻瘟菌不同发育和致病过程
N糖基化修饰在稻瘟菌致病过程中发挥重要功能,前期研究表明N糖基化可以通过修饰稻瘟菌效应蛋白Slp1来逃避寄主免疫反应。为进一步系统研究N糖基化在植物病原真菌中的作用,本研究采用定量修饰蛋白组学的策略,对模式病原真菌稻瘟菌营养菌丝,分生孢子,以及附着胞各阶段的N糖基化蛋白进行了大规模鉴定和比较,共鉴定到355个蛋白的559个N糖基化位点。通过靶标蛋白功能分类和比较,发现N糖基化可以通过修饰不同类别的靶标蛋白,来协调菌丝,分生孢子以及附着胞分化等不同生物学发育过程(图1)。研究还表明,N糖基化修饰的靶标蛋白中包含许多参与N糖基化,O糖基化以及GPI锚定修饰等过程的关键蛋白,表明三种糖基化修饰之间存在相互协同的现象。
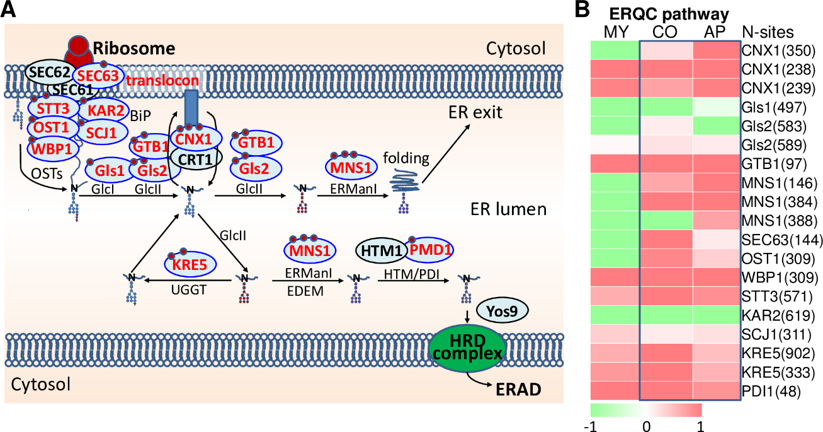
图2 N糖基化修饰调控稻瘟菌ERQC系统
研究发现,参与细胞内质网质量控制(ERQC)系统的绝大部分关键蛋白均被鉴定为N糖基化蛋白(图2),暗示N糖基化修饰对保证分泌蛋白的正确翻译和折叠等质量起着关键调控功能。为进一步证实这一发现,将ERQC系统的关键蛋白编码基因Gls1, Gls2, GTB1和Cnx1分别进行了敲除和功能验证,结果表明这些基因对菌丝生长,分生孢子发育以及侵染菌丝扩展等过程均十分重要。接下来对Gls1的N糖基化修饰及其位点N497进行了验证,表明N497糖基化修饰可以调控Gls1的蛋白稳定性和内质网定位,从而影响ERQC系统的生物学功能。
本研究全方位展示了植物病原真菌N糖基化修饰在生物学过程,生长发育以及致病过程中的功能,可为深入理解植物病原真菌的致病机理,开发真菌病害防控策略提供新的思路,同时可为研发新的杀菌剂提供新的候选靶标。
植科学院陈小林副教授为论文第一作者,中国农科院植物保护研究所刘文德研究员为通讯作者,华中农业大学为第一完成单位。此外,英国The Sainsbury Laboratory的唐博增博士和美国俄亥俄州立大学王国梁教授也参与了本项研究,该研究得到植物病虫害生物学国家重点实验室开放课题等项目资助。
2月16日陈小林课题组在国际权威期刊Environmental Microbiology发表了另外一篇关于糖基化修饰(GPI锚定修饰)的研究论文,题为“GPI7-mediated glycosylphosphatidylinositol (GPI) anchoring regulates appressorial penetration and immune evasion during infection of Magnaporthe oryzae”。
目前关于GPI锚定修饰在植物病原真菌中功能和作用机制的目前还不是很清楚,这主要是由于GPI锚合成途径的基因往往敲除后会致死,而GPI锚定蛋白由于功能的冗余性,敲除后又可能没有明显的表型缺陷。本研究对GPI锚合成途径基因GPI7成功进行了敲除,生物学表型分析发现,GPI锚定修饰对于稻瘟菌细胞壁完整性,环境响应,菌落生长,分生孢子形成,附着胞穿透能力,以及侵染菌丝扩展均十分重要。
GPI锚定修饰通过调控细胞壁完整性影响附着胞穿透寄主。本研究揭示了真核生物第三种糖基化修饰(GPI锚定修饰)在植物病原真菌中的生物学意义,尤其是在致病过程中的重要功能。
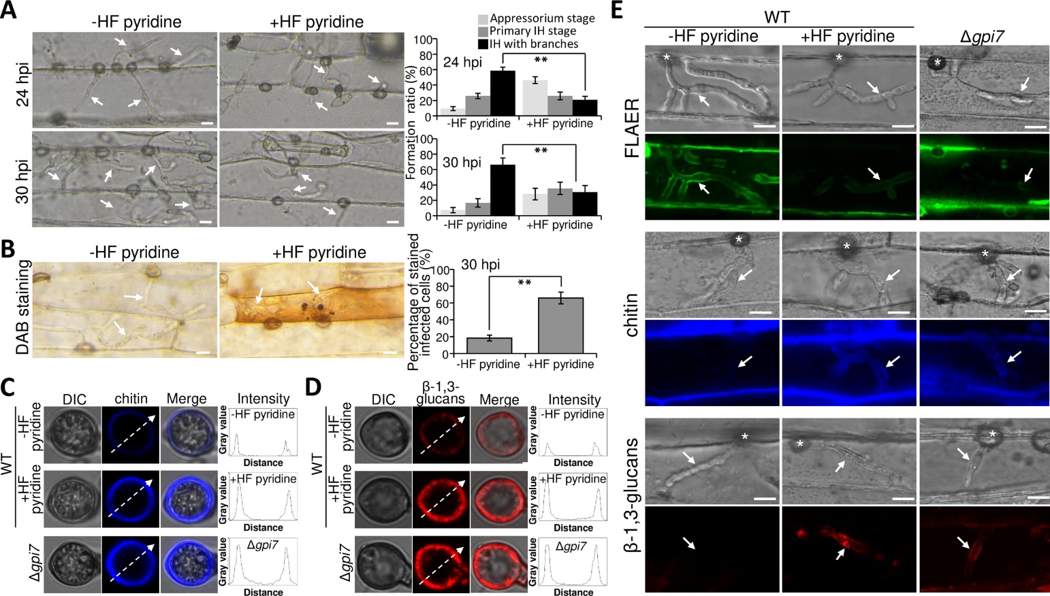
图3 GPI锚定蛋白可保护细胞壁几丁质和β-(1,3)葡聚糖免受寄主防卫机制识别
真菌细胞壁从内到外分别由几丁质(chitin),β-(1,3)葡聚糖,β-(1,6)葡聚糖以及GPI锚定蛋白等结构组成。由于几丁质和β-(1,3)葡聚糖均为可以被寄主识别诱发抗病反应的病原相关分子PAMPs(pathogen-associated molecular patterns),病原菌进化出了可以避免被寄主识别PAMPs的机制。本研究发现,真菌细胞壁上的GPI锚定蛋白可保护附着胞和侵染菌丝的几丁质和β-1,3-葡聚糖免受寄主防卫机制识别,从而实现免疫逃避,帮助稻瘟菌致病(图3)。通过全基因组生物信息学预测,发现219个GPI锚定蛋白,参与不同生物学过程。其中Gel家族的Gel1,Gel2,Gel3,Gel4和Gel5均预测为GPI锚定蛋白。
研究进一步证明,GPI锚定修饰可调控Gel家族蛋白的丰度和细胞壁定位,从而保护PAMPs,以免被寄主识别。GPI锚定修饰帮助真菌实现免疫逃避的机制在植物病原真菌中是首次发现。由于GPI-锚的结构及生物合成对于病原真菌的致病性是必须的,那么抑制GPI-锚的生物合成将成为抗真菌药物的有效靶点,通过破坏 GPI-锚的结构或阻碍其生物合成,破坏真菌的GPI锚定蛋白,有可能使寄主能够轻易地降解病菌的细胞壁chitin和β-(1,3) 葡聚糖,从而使病原真菌丧失侵染能力。
植科学院2018级博士研究生刘彩云为论文第一作者,陈小林副教授为通讯作者,华中农业大学为第一完成单位。植科学院黄俊斌教授、中国农业大学彭友良教授,以及英国The Sainsbury Laboratory的Lauren Ryder博士也参与了该研究。该研究得到国家自然科学基金(31601585, 31871909)等项目的资助。
审核人:陈小林
论文链接:

