我校“多米诺”纳米反应器用于细菌感染精准治疗
南湖新闻网讯(通讯员 吴阳 宋智勇)10月2日,我校韩鹤友教授领衔的纳米化学生物学团队在国际学术期刊Nature Communications在线发表了题为《Endogenous stimulus-powered antibiotic release from nanoreactors for a combination therapy of bacterial infections》研究论文。本研究巧妙利用α-溶血素能够在细胞膜上穿孔这一特性,通过负载抗菌药物和反应底物,仿生构建了一种类细胞膜包裹的“多米诺”纳米反应器,实现了细菌毒素触发的级联反应和药物的靶向及可控释放,并进一步刺激机体免疫反应,达到了药物治疗和免疫治疗的协调抗菌效果。
抗生素的过度使用(滥用)已成为当前全世界面临的严峻公共卫生问题,由此带来的危害是细菌产生了耐药性(即出现了“超级细菌”),造成抗生素对细菌感染治疗效果的显著下降甚至失效。为应对这一挑战,细菌耐药性的相关研究已成为当前多学科交叉研究的热点,纳米技术的引入为解决这一问题提供了新的策略。
耐甲氧西林金黄色葡萄球菌(MRSA)是世界卫生组织确认的对人类健康构成巨大威胁的十几个抗生素“超级细菌”之一,并将其列为威胁公共卫生的六种“高度优先”病原体之一。MRSA能够分泌多种毒力因子,使其在宿主中定殖、侵袭和复制,这些毒力因子可以靶向并破坏细胞膜,并在细胞内发挥作用,并且对其靶细胞具有高度特异性。Hlα毒素(α-溶血素)是金黄色葡萄球菌分泌的一种穿孔蛋白类溶血素,损伤人和动物的红细胞、血小板,促进小血管平滑肌收缩、痉挛,导致毛细血管流阻滞和局部缺血坏死。
在一个相互联系的系统中,一个很小的初始能量可能产生一系列的连锁反应,人们把这种现象称为"多米诺"效应。在本研究中,韩鹤友教授团队巧妙利用α-溶血素能够在细胞膜上穿孔这一特性,通过负载抗菌药物和反应底物,仿生构建了一种类细胞膜包裹的“多米诺”纳米反应器,实现了细菌毒素触发的级联反应和药物的靶向及可控释放,并进一步刺激机体免疫反应,达到了药物治疗和免疫治疗的协调抗菌效果。
如图A所示,当纳米反应器处于室温(25℃)时,内层为固态的相转换材料能够很好地保护过氧化钙和抗生素(RFP)以防止其释放;当温度达到37℃(相转换温度)时,内层的相转换材料会由固态转变为液态,一旦遇到金黄色葡萄球菌,细菌分泌的毒素被纳米反应器捕获并在其表面打孔,水分子通过孔道进入纳米反应器与纳米过氧化钙反应产生过氧化氢,而过氧化氢进一步分解产生氧气会使纳米反应器体积膨胀,从而会促进抗生素的大量释放,达到抗菌,清除毒素并促进伤口愈合的效果。
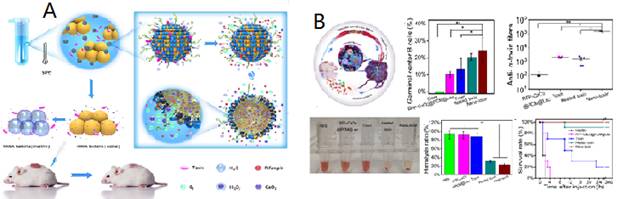
示意图
与此同时,纳米反应器(图B)可以有效的吸附细菌毒素(nano-toxin),但不破坏毒素的结构和功能,同时降低毒素对细胞膜的损伤;进一步被捕获的纳米毒素,通过血液循环呈递给淋巴细胞,刺激机体产生免疫反应并分泌具有中和效应的抗体,实现了对体内毒素的有效中和,最终达到了药物治疗和免疫治疗的协调抗菌效果。
本研究是继Advanced Functional Materials, 2018, 28, 1800011;ACS applied materials & interfaces, 2019, 11, 32659等纳米材料用于超级细菌感染治疗研究的又一重要进展。
博士研究生吴阳和青年教师宋智勇博士为该论文的共同第一作者,韩鹤友教授为通讯作者。上述研究成果获得国家自然科学基金及校自主创新项目资助。
审核人:韩鹤友
论文链接:https://www_nature.gg363.site/articles/s41467-019-12233-2

