活细胞中蛋白质相互作用研究取得进展
近日,中国科学院上海药物研究所陈小华课题组和中国科学院成都生物研究所唐卓课题组合作,基于开发新的非天然氨基酸,发展了一种能够在活细胞中捕捉蛋白质相互作用的新技术,该方法兼具时空可分辨和交联位点选择性的优势。研究成果“Genetically Encoded Residue-Selective Photo-Crosslinker to Capture Protein-Protein Interactions in Living Cells”在线发表于Cell出版社子刊Chem 杂志。
蛋白质相互作用在生命活动中扮演非常重要的角色,发现蛋白质新的相互作用或功能将有助于阐明特定生命过程,为相关疾病的治疗提供理论基础。然而蛋白质相互作用网络十分复杂,在活体条件下开展蛋白质相互作用研究非常具有挑战性。基于基因密码子拓展技术,在活体细胞的目标蛋白质中定点引入具有共价交联活性的非天然氨基酸,已经成为活细胞内研究蛋白质-蛋白质相互作用的有力工具。
研究团队针对现有非选择性的蛋白质交联技术产生的交联肽段结构复杂、质谱数据难以解析、假阳性高等关键问题,发展了一种时空可分辨的残基选择性(residue-selective)共价交联新方法,成功实现了在活细胞中对相互作用的蛋白质复合物的有效捕捉及后续质谱的分析。通过对多种相互作用蛋白质(如乙酰化酶与底物)的研究,该技术可以捕捉活细胞中微弱的蛋白质相互作用;其获得蛋白质的交联肽段可以很大程度上简化质谱的分析、作为确定蛋白质相互作用的直接证据、确定相互作用的界面以及验证酶与特定底物的相互作用。该方法在一定程度上突破了传统蛋白质相互作用分析、发现方法的瓶颈,有望被广泛用于传统方法难以发现的活细胞中微弱的、瞬间的或呈动态作用方式的蛋白相互作用的研究。
陈小华、唐卓为论文的共同通讯作者,陈小华课题组胡伟为该论文第一作者;上海药物所谭敏佳课题组参与此项工作。该研究得到上海药物所质谱技术服务部的支持,该项目得到国家自然科学基金委、中科院、上海市科委项目的资助。
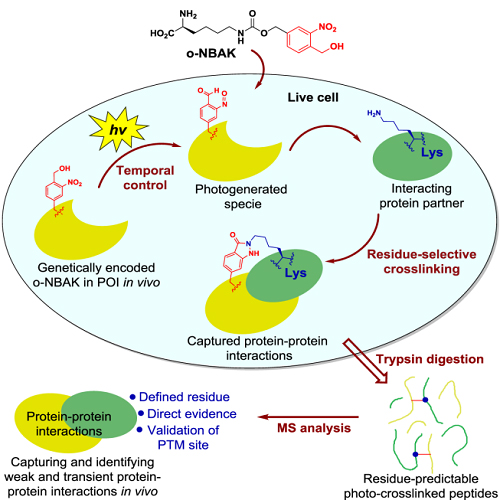
具有时空可分辨的捕捉活细胞中蛋白质相互作用技术示意图

