分子植物卓越中心发现真菌利用小RNA抑制蚊虫免疫反应新机制
9月20日,中国科学院分子植物科学卓越创新中心/植物生理生态研究所王四宝研究组在国际学术期刊《自然-通讯》(Nature Communications)上在线发表了题为A fungal pathogen deploys a small silencing RNA that attenuates mosquito immunity and facilitates infection 的研究论文。该研究揭示了杀虫真菌以sRNA作为效应因子实施跨界抑制昆虫免疫反应并促进感染的新机制。
蚊子是疟疾、登革热、寨卡、脑炎等多种疾病的传播媒介。人类与疟疾的斗争历史有千年之久,但疟疾发病率和致死率至今仍居高不下。据世界卫生组织报告,2017年全球仍有90多个国家共2.19亿人感染疟疾,死亡人数高达50万。疟疾曾长期在我国肆虐,严重危害我国人民生命健康。我国消除疟疾工作取得明显进展,但随着全球化和国际交往日益频繁,近年我国境外输入性疟疾病例呈显著上升趋势。
蚊虫控制是防控蚊媒疾病的重要措施,但是由于化学杀虫剂的长期广泛使用,蚊虫已对化学农药产生了普遍抗性,加上疟原虫耐药性问题的出现和疫苗的缺乏,亟需发展新的方法和策略用于蚊媒疾病的防控。杀虫真菌可以通过体壁侵染并杀死昆虫,在蚊虫生物防治和阻断病原传播上具有巨大优势,是一种环境友好型的生物杀虫剂。因此,开展杀虫真菌与蚊虫互作机理研究,对研发高效生物杀虫剂具有重要意义。昆虫和真菌的相互作用是一个复杂的过程,昆虫具有高效的免疫系统对抗微生物感染,真菌必须有效抑制昆虫免疫反应才能成功感染。研究团队前期研究发现,杀虫真菌通过抑制肠道免疫来操纵肠道细菌协同杀蚊的互作新机制(Wei et al., 2017. PNAS)。病原菌与寄主昆虫在长期的进攻和防御“军备竞赛”中,进化出能够帮助其破坏或抑制昆虫免疫反应的因子(即效应因子)。然而,杀虫真菌是否也利用效应因子进入昆虫细胞内靶向调控昆虫基因的表达来抑制寄主免疫反应却知之甚少。
该研究发现杀虫真菌球孢白僵菌在刚开始侵染蚊虫体壁时,会显著上调表达一种微小RNA (命名为milR1),其通过与囊泡结合以“搭便车”的方式进入昆虫细胞内后,与昆虫RNA诱导沉默复合体中的AGO1蛋白结合来劫持宿主RNA干扰途径,选择性地靶向沉默昆虫Toll免疫通路中的配体Spatzle 4 的表达,进而抑制蚊虫抗真菌免疫反应(该免疫反应产生抗菌肽)。当真菌侵入蚊子血腔内后,持续表达的milR1会激活血细胞中的靶基因CLIPB9 (一个含有发夹结构域的丝氨酸蛋白酶基因)的表达而引起黑化免疫反应(产生有杀菌作用的黑色素),但此时真菌会迅速降低milR1的表达至极低水平,再次成功逃避蚊虫的免疫“攻击”,最后达到成功侵染并杀死蚊虫的目的。这一研究不仅发现了杀虫真菌新的致病机理,而且开辟了一个新的研究方向,为发展高效蚊虫生防制剂提供了新思路。
王四宝研究组的博士研究生崔春来和王燕为该论文的共同第一作者,博士生孙佩璐、博士后赵静、上海科技大学生命科学学院副研究员刘竞男合作参与了该项研究工作,研究员王四宝为通讯作者。该研究得到中科院战略性先导科技专项(B类)、国家重点研发项目、国家自然科学基金等资助。
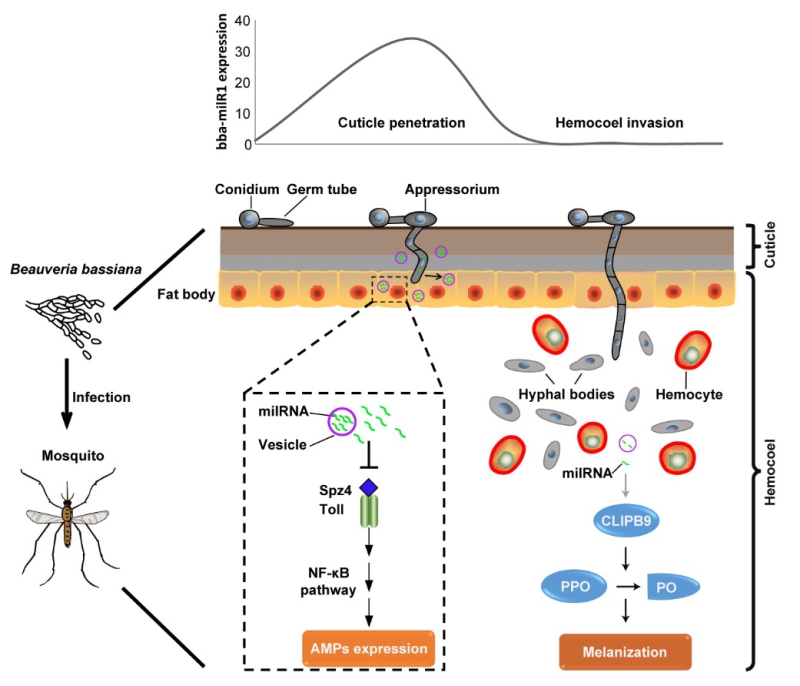
图:真菌利用sRNA作为效应因子实施跨界调控寄主蚊虫抗真菌免疫反应的机制

