β-氨基异丁酸能够促进脂肪细胞中与卡路里燃烧相关基因表达增
哈佛医学院麻省总医院心脏病学部和心血管研究中心的研究人员发现,β-氨基异丁酸(BAIBA)使得脂肪细胞中与卡路里燃烧有关的基因表达增高。BAIBA是PGC-1∝蛋白调控的一种代谢产物。它还减少了小鼠的体重增长,帮助平衡了血糖水平。相关文章发表于2014年1月7日的《Cell Metabolism》杂志上。
尽管人们清楚地知道锻炼能够促进健康和长寿,但对于身体内推动这些益处的改变却并不是太清楚。现在研究人员发现,在锻炼过程中生成的一种分子促成了锻炼对于代谢的有益影响。
论文的资深作者、哈佛医学院麻省总医院心脏病学部和心血管研究中心Robert Gerszten博士说:“我们研究结果支持了一个基本的观点:一个器官如锻炼肌肉所生成的信号被释放到血液循环中,影响了脂肪细胞和肝脏等其他的组织。”
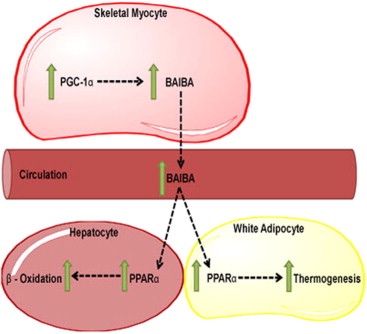
研究证实,一种叫做PGC-1∝的蛋白调控了肌肉中的一些代谢基因,促成了肌肉对锻炼产生反应,但目前尚不清楚PGC-1∝-介导的肌肉对锻炼的反应是如何将信号传送到其他组织的。
采用细胞和小鼠开展实验,Gerszten和同事们迫使肌肉细胞中表达PGC-1∝,随后寻找了细胞分泌的代谢产物。他们确定了β-氨基异丁酸(BAIBA)是其中的一种代谢产物,并证实它使得脂肪细胞中与卡路里燃烧有关的基因表达增高。它还减少了小鼠的体重增长,帮助平衡了血糖水平。
针对一些人类锻炼研究和Framingham心脏研究参与者进行分析的结果揭示,在锻炼过程中BAIBA水平升高,且其与一些代谢风险因子呈负相关。具体说来,BAIBA的水平与空腹血糖水平、胰岛素、甘油三酯和总胆固醇呈负相关。此外,还与身体质量指数(body mass index)呈现一种负相关的趋势。
这些研究结果表明,BAIBA可能促成了锻炼预防一些代谢性疾病。“操控BAIBA或是生成BAIBA的酶有可能具有治疗潜力。燃烧脂肪有可能影响与糖尿病、心脏病和其他疾病相关的代谢健康的多个方面,”Gerszten说。
原文摘要:
β-Aminoisobutyric Acid Induces Browning of White Fat and Hepatic β-Oxidation and Is Inversely Correlated with Cardiometabolic Risk Factors
Lee D. Roberts,Pontus Boström,John F. O’Sullivan,Robert T. Schinzel,Gregory D. Lewis,Andre Dejam,Youn-Kyoung Lee,Melinda J. Palma,Sondra Calhoun,Anastasia Georgiadi,Ming-Huei Chen,Vasan S. Ramachandran,Martin G. Larson,Claude Bouchard,Tuomo Rankinen,Amanda L. Souza,Clary B. Clish,Thomas J. Wang,Jennifer L. Estall,Alexander A. Soukas,Chad A. Cowan,Bruce M. Spiegelman,Robert E. Gerszten
The transcriptional coactivator peroxisome proliferator-activated receptor-gamma coactivator-1α (PGC-1α) regulates metabolic genes in skeletal muscle and contributes to the response of muscle to exercise. Muscle PGC-1α transgenic expression and exercise both increase the expression of thermogenic genes within white adipose. How the PGC-1α-mediated response to exercise in muscle conveys signals to other tissues remains incompletely defined. We employed a metabolomic approach to examine metabolites secreted from myocytes with forced expression of PGC-1α, and identified β-aminoisobutyric acid (BAIBA) as a small molecule myokine. BAIBA increases the expression of brown adipocyte-specific genes in white adipocytes and β-oxidation in hepatocytes both in vitro and in vivo through a PPARα-mediated mechanism, induces a brown adipose-like phenotype in human pluripotent stem cells, and improves glucose homeostasis in mice. In humans, plasma BAIBA concentrations are increased with exercise and inversely associated with metabolic risk factors. BAIBA may thus contribute to exercise-induced protection from metabolic diseases.

