汤富酬课题组与合作团队发表人类着床前胚胎发育的单细胞多组学研究成果
汤富酬课题组与合作团队发表人类着床前胚胎发育的单细胞多组学研究成果

图片设计源于“八卦”,在此代表人类来自精子的父源基因组与来自卵细胞的母源基因组在受精后的“阴阳融合”。整幅画面传递着人类受精卵在发育过程中,父源基因组(金色蛇)染色质快速打开并且其开放程度迅速超过母源基因组(红色蛇),并将这一逆转的开放程度不对称状态一直维持到4-细胞胚胎阶段这一含义。
2018年6月18日,北京大学北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心、生命科学学院生物动态光学成像中心汤富酬课题组携手北京大学第三医院乔杰课题组合作在国际知名学术期刊《Nature Cell Biology》在线发表了题为"Single-cell Multi-omics Sequencing of Human Early Embryos"的研究论文。利用汤富酬课题组发展的高精度的单细胞多组学测序技术“single-cell COOL-seq” (Cell Research, 2017),首次在单细胞分辨率,解析了人类着床前胚胎发育过程中DNA甲基化组和染色质状态组的重编程过程,以及染色质状态与DNA甲基化之间的相互关系等关键生物学特征。
汤富酬教授课题组和乔杰教授课题组长期紧密合作,致力于人类着床前胚胎发育过程中基因表达的表观遗传学调控机理方面的研究。采用汤富酬课题组发展的单细胞RNA-seq转录组测序技术,于2013年绘制了完整的人类着床前胚胎的高精度单细胞转录组图谱(Nature Structural & Molecular Biology, 2013);之后利用汤富酬课题组发展的微量细胞DNA甲基化组高通量测序技术,于2014年在国际上首次实现了对人类早期胚胎发育过程中DNA甲基化组重编程的系统研究(Nature, 2014)。2018年该团队利用单细胞DNA甲基化高通量测序技术,首次在单细胞分辨率深入解析了人类着床前胚胎发育的DNA甲基化组图谱(Nature Genetics, 2018),揭示了人类着床前胚胎的去甲基化重编程,实际上是高度有序的大规模去甲基化和局部的DNA加甲基化动态平衡的结果,并揭示了父母源基因组差异甲基化等特征。
为了进一步在极限分辨率研究染色质状态在DNA甲基化重编程过程中的动态重构过程,该研究利用汤富酬课题组发展的国际领先的单细胞多组学测序技术(single-cell COOL-seq),在单细胞、单碱基分辨率系统地描绘了人类着床前胚胎发育过程中,各个发育阶段表观基因组多个层面的动态变化。对于存在高比例非整倍体的样品(例如人类着床前胚胎、人类癌症样品等),利用少量细胞的表观基因组测序方法,例如ChIP-seq、ATAC-seq、DNase-seq等,得到的结果有可能会被混杂在样品中的异常的非整体细胞所混淆。因此该研究利用汤富酬课题组发展的scCOOL-seq技术,可以在单细胞水平有效地区分整倍体和非整倍体细胞,在排除非整倍体细胞后、利用整倍体胚胎的单细胞数据,更为精准地反映人类着床前胚胎发育过程中表观基因组多层面的动态变化。该研究的主要发现有:
(1)受精后的19个小时以内,高度特化的精子和卵子都经历了大规模的染色质重构过程,来自精子的父源基因组染色质被迅速打开,而来自卵细胞的母源基因组染色质的开放程度降低(精子的平均染色质开放程度为5%,卵子为42%,受精卵为34%)。随后父母源基因组染色质的开放程度同时回落,直至合子基因激活的8-细胞胚胎阶段之后染色质开放程度再次增加,到桑椹胚阶段染色质开放程度达到最高点(2-细胞的平均染色质开放程度为32%, 4-细胞为30%, 8-细胞为27%,桑椹胚时期为40%;图1a)。利用该研究鉴定出的61,403个近端染色质开放区域进行非监督层次聚类分析发现,和小鼠胚胎相似,在人类早期胚胎发育过程中,近端染色质开放区域具有强烈的发育阶段特异性,更重要的是近端染色质开放区域在合子基因激活时期,即4-细胞到8-细胞时期,发生了最剧烈的染色质重构过程,着床前胚胎聚类分为两支,一支是4-细胞阶段之前的胚胎,另外一支是8-细胞阶段之后的胚胎(图1b)。
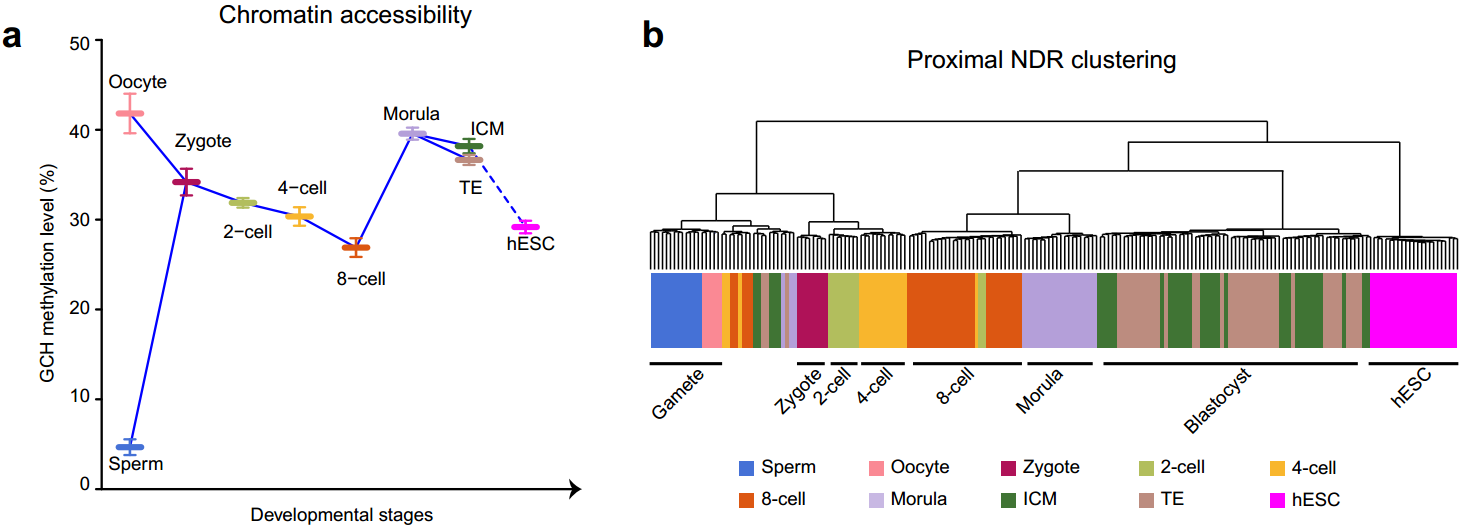
图1:人类着床前胚胎(整倍体胚胎)发育过程中染色质开放程度的动态变化(a)以及近端(基因启动子区域)染色质开放区域的非监督层次聚类分析(b)
(2)首次发现不同于小鼠受精卵,人类受精卵在发育过程中父源基因组染色质快速打开并且其开放程度迅速超过母源基因组,并将这一逆转的父母源基因组染色质开放程度不对称状态一直维持到4-细胞胚胎阶段。该研究首次实现了在人类着床前胚胎的单个细胞内,将父母源基因组信息精确分开并进行DNA甲基化和染色质开放程度的分析(图2a)。在此基础上,该研究发现,人类受精卵在受精后19个小时左右,其父源基因组的染色质已经比母源基因组更为开放,并且这一不对称状态一直维持到4-细胞胚胎阶段才结束(图2b)。这与小鼠中完全不同,小鼠胚胎在受精后很快每个胚胎细胞中其父源基因组染色质的开放程度变得跟母源基因组的一样,并且此后一直维持这种父母源基因组染色质开放程度的对称状态。人类受精卵中父源基因组更快速打开并且开放程度迅速超过母源基因组,这可能更有利于DNA去甲基化酶在父源基因组上的结合,从而加速父源基因组的去甲基化进程以及其他表观遗传学重编程进程。
(3)首次发现不同于小鼠胚胎,人类着床前胚胎具有更为开放、松散的染色质结构。该研究首次实现了对人类与小鼠着床前胚胎父母源基因组染色质开放程度的系统定量比较(图2c)。基于同一技术平台的绝对定量比较,该研究发现与小鼠胚胎相比,在对应的胚胎阶段,人类着床前胚胎具有更开放松散的染色质结构,而这一松散的染色质结构有可能更容易出现基因组不稳定性,进而导致人类着床前胚胎发育到囊胚阶段的比率远低于小鼠(人类胚胎的囊胚发育率只有40-60%,而小鼠胚胎的囊胚发育率高达95%以上)。小鼠胚胎的父源基因组和母源基因组在受精后被迅速打开,之后染色质开放程度回落,到2-细胞时期达到最低点;与此不同,人类胚胎母源基因组在受精后其染色质开放程度即开始下降,至8-细胞阶段降至最低点。而人类胚胎父源基因组在受精后先被迅速打开,之后染色质开放程度逐渐回落,到8-细胞阶段降至最低点。人类和小鼠染色质状态重构模式的差异刚好与这两个物种合子基因激活时间的差异吻合。


