超短DNA低甲基化区域和染色质3D结构的关系
DNA甲基化修饰一直是备受关注的表观遗传修饰。全基因组亚硫酸盐测序(WGBS)作为绘制DNA甲基化谱的金标准,有着单碱基高分辨率和全基因组高通量的优势,因此,全面解析DNA甲基化谱并挖掘其调控功能,是表观遗传学研究的前沿课题。美国贝勒医学院的Wei Li (李蔚) 教授领导的团队在Genome Biology杂志上发表了题为 ‘Sparse conserved under-methylated CpGs are associated with high-order chromatin structure’ 的研究论文。该论文通过创新的计算方法发现了一种新的与染色质3D结构相关的表观调控元件 --稀疏保守低甲基化CpG(scUMC: Sparse conserved under-methylated CpGs),为表观遗传调控提供了新的研究思路。
DNA甲基化在正常发育和疾病发生等多种生物学过程中发挥重要的调控作用。在整个DNA甲基化组中,高度甲基化CpG占据了大部分(70%-80%),低甲基化CpG簇聚形成低甲基化区域,通常聚集在基因调控区,人们已经发现了一些富集于启动子、增强子和转录因子结合区域的低甲基化DNA元件。以往的DNA甲基化分析方法通常认为邻近的CpG甲基化水平亦高度一致。因此,为了增加分析的可信度,传统方法通常要求低甲基化区域必须包括至少4个低甲基化CpG。在这个过程中,丢弃了大量的稀疏分布的低甲基化 CpG。另外,尽管WGBS是单碱基分辨率,但是传统的方法并不能从单碱基分辨率预测甲基化的功能。本研究通过开发新颖的计算方法,检测出具有功能的单碱基稀疏保守低甲基化CpG (scUMC) , 并整合染色质高级结构数据深入解析了其潜在的调控功能。
本研究发现,跟之前检测出来的低甲基化CpG簇聚区域相比,绝大部分的单碱基低甲基化CpG是随机分布在每个样本中。因此,从大量噪音中检测出具有功能性的单碱基低甲基化CpG的关键是有效地区分、排除随机分布的单碱基低甲基化CpG。本研究巧妙地从另一个维度出发,纵向整合高质量WGBS数据(31套人类正常细胞系WGBS数据)中单碱基低甲基化CpG在多个样本中的相关性,开发出新的计算方法,检测出9,421个功能性的单碱基低甲基化CpG。 这些单碱基低甲基化CpG大部分处于染色质开放区域(DNase I hypersensitivity site),提示了这些低甲基化位点基因调控的功能。 跟传统的低甲基化CpG簇聚区域不同,这些单碱基低甲基化CpG稀疏分布在高甲基化背景中, 并且其序列及低甲基化水平具有保守性,所以研究人员将其称为稀疏保守低甲基化CpG(scUMC: Sparse conserved under-methylated CpGs)。scUMC有着独特的,跟之前低甲基化簇聚区域不同的特征。scUMC不处于CpG密集区域,相应地,不处于CpG岛和及其周围区域。结合ENCODE项目定义的功能元件和161转录因子ChIP-seq数据,进一步分析表明,scUMC富集于非启动子和非增强子的转录因子结合位置(distal TFBS) 。
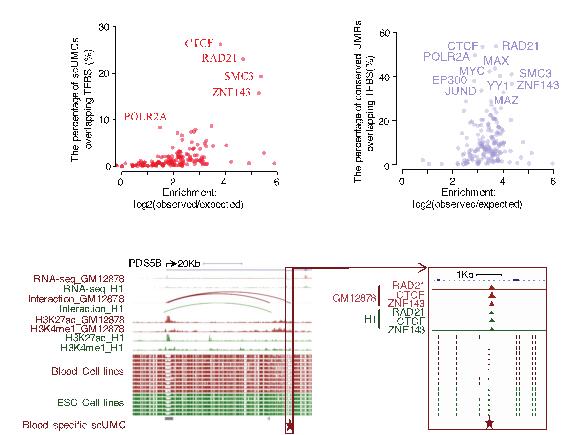
161个转录因子的富集性分析表明,scUMC特异地跟4个染色质环因子(Rad21、SMC3、CTCF、ZNF143)相关,并且相应地富集于DNA环绑定结互作两端上。细胞核中DNA环是细胞的基础功能结构,其形成和解体允许细胞建立各种高级染色质3D结构,并实现基因调控功能。之前的研究表明Rad21、SMC3、CTCF、ZNF143这些转录因子在细胞核内负责组织染色质3D 结构,他们聚集在一起成为绑定结,将增强子从远端拉到启动子区域对基因进行转录调控,形成并维持丝带样的DNA环。ChIA-PET测序技术能够在基因组范围内找出与特定转录因子相关的DNA环。为了进一步研究scUMC如何参与染色质3D 结构的形成,本研究有效地利用现有的公共数据将scUMC甲基化水平与染色质环因子和DNA环关联起来。结果表明,尽管scUMC周围背景是高甲基化,但是随着单个碱基scUMC甲基化增高,染色质环因子结合DNA强度减弱,DNA环绑定结两端互作也相应地减少;更进一步,相应DNA环调控的基因表达下降。这项研究检测出调控基因转录的新的表观遗传学元件,有助于开辟新的表观调控研究方向:单个CpG甲基化关联染色质高级结构调控基因表达。

通讯作者:Wei Li (李蔚), 贝勒医学院生物信息学教授。李蔚博士多年来在大规模的基因组数据分析方面做出了很多杰出的原创性贡献,并与实验生物学家通力合作、优势互补,从生物信息学的角度去诠释疾病尤其是与肿瘤发生过程中的许多关键问题。李蔚教授作为项目负责人从2008到目前为止已在国际知名期刊发表了100余篇同行评议的论文,其中有30余篇发表在了Nature、Science以及Cell杂志系列上。李蔚博士发表的论文在Google Scholar 上的总引用次数已经超过了22,000, H-index 为53。李蔚博士目前担任美国国立卫生研究员(NIH)和德州癌症基金会多个研究项目的PI和共同PI。过去的五年, 为实验室获得了约500万美元的政府研究基金。他实验室培养的学生已经有5名在美国一流研究型科研机构找到了独立的(tenure track)助理教授的位置。

第一作者:林雪秋,同济大学博士,导师李蔚教授。博士期间针对DNA甲基化及其它表观修饰开发相关的计算工具和方法,主要从大数据出发解析表观遗传调控在细胞分化和肿瘤发生中的作用。 相关研究成果发表在Nature genetics、Genome Biology, Bioinformatics等国际一流期刊上。(来源:科学网)

