CRISPR 最新重大进展:基因编辑技术终于出现“停止键”
随着 CRSIPR 的大热,基因编辑技术已经离我们越来越近。但事实上,这项技术依旧存在着不小的隐患,其中最大的一个问题就是基因编辑的脱靶效应。
这是因为,基因编辑一旦开始就无法中断,只能等待整个过程自然结束,就好像一辆汽车只有油门但是没有刹车。在修复了错误基因后,细胞里的基因编辑工具很可能会继续修改本来正常的基因。因此,科学家一直想在基因编辑的工具箱里加上一套“刹车装置”。
2017年8月24日,著名的基因编辑专家,CRSIPR-Cas9 系统的共同发现者 Jennifer Doudna 和她的同事在《细胞》杂志上发表了一篇论文(A Broad-Spectrum Inhibitorof CRISPR-Cas9),他们发现了两个可以终止基因编辑过程的蛋白质。不仅如此,他们还发现这两个蛋白质属于一个很大的蛋白质家族,这个蛋白质家族对不同的基因编辑系统有广谱抑制性,意味着在未来的终止基因编辑过程中可能得到广泛应用。
这项研究不仅能让研究人员更加深入地理解基因编辑系统,而且还可以给他们提供一套操作工具,能更好地控制基因编辑系统,让它变得更精确,副作用也更少。
CRISPR-Cas9 系统本来是细菌用来抵御病毒的免疫工具。不过在过去几年,研究人员发现这套系统也可以相对精确地定向修改哺乳动物和植物等生物的基因。因此已经有大量的研究开始关注 CRISPR-Cas9 在遗传疾病治疗和转基因物种培育等领域的潜在应用。
在健康领域,中国和美国都已经开始了相关的临床试验,这标志着 CRISPR-Cas9 已经逐渐走出实验室,进入市场应用前的最后阶段。很多人相信,基因编辑很快就能被用于临床治疗。
然而 CRISPR-Cas9 系统也有问题。作为潜在的医疗手段,它的精确度仍然不够。例如,有时候基因编辑会出现在我们不想要的地方,产生脱靶效应。另外,因为基因编辑非常强大,生物伦理学领域的学者也担心在实验室外使用基因编辑是否会产生可怕的后果。因此,科研人员面临的一个重要问题是找到更多可以精确控制基因编辑的工具,让这种技术变得更加安全可靠。
就像发现 CRISPR 系统那样,研究人员再次把目光转向了自然界。CRISPR 系统是细菌用了数亿年时间,进化出来的抵御病毒攻击的防御性武器。当病毒入侵后,细菌可以捕捉到病毒的 DNA 片段。如果病毒再次入侵,细菌就能根据之前的记录找到入侵者的 DNA,然后再利用 Cas9 的蛋白质把病毒 DNA 摧毁。
不过,细菌和病毒之间的斗争已经持续了很久。病毒也同样进化出一套机制来抵御细菌的免疫系统。它们的基因组可以合成一些蛋白质,这些蛋白质能抵抗细菌的防御性武器 Cas9。
此前,已经有多项研究发现了至少 7 种蛋白质,可以抑制 Cas9,让细胞无法切割编辑 DNA。研究人员将这些对抗 CRISPR 的蛋白质统称为 ACR 抗 CRISPR 蛋白(anti-CRISPR protein,简称 ACR)。不过,他们基本不清楚这些 ACR 蛋白是如何工作的。
所以,Doudna 和她的同事决定弄清楚 ACR 蛋白的机理和作用范围。他们选了两个 ACR 蛋白:ACRIIC1 和 ACRIIC3。选择这两个蛋白的原因是它们都可以在人体细胞里,非常有效地抑制一个很常用的 Cas9 蛋白。
有趣的是,研究人员发现,这两种蛋白质抑制基因编辑的方式截然不同。ACRIIC1 可以抑制很多不同的 Cas9 蛋白,有广谱抑制剂的效果。当它在细胞中遇到 Cas9 以后,可以紧紧地结合在 Cas9 用来抓住 DNA 的位置上,让它无法再与 DNA 结合,并进一步切割破坏 DNA。这就好像在插线板上插入一个塑料保护套,就无法连上插头一样。
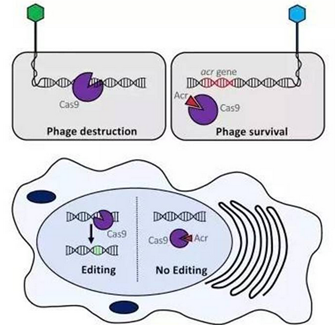
左上:紫色的“DNA 剪刀”Cas9 蛋白可以切割基因,完成基因编辑的过程。右上:当红色的 ACR 和紫色的 Cas9 结合以后,Cas9 无法再和 DNA 结合,基因编辑终止。
研究人员通过 X 射线结晶法,获得了清晰的 ACRIIC1 和 Cas9 结合在一起的结构。具体地说,ACRIIC1 上的两个氨基酸(S78 和 C79)和 Cas9 上的两个重要的氨基酸(H588 和 D587)之间形成了紧密联系,而 H588 和 D587 本来是 Cas9 用来抓住目标 DNA 的。(如下图)
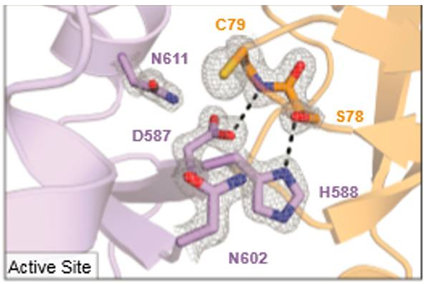
Doudna 团队获得了 ACR 蛋白(橘黄色)和 Cas9 蛋白(紫色)结合的清晰结构。ACR 蛋白的两个氨基酸(C79 和 S78)分别与 Cas9 的两个氨基酸(D587 和 H588)形成了化学键。
另一个 ACR 蛋白 ACRIIC3 的作用机理则完全不同。首先,它更加专一,只能抑制一种 Cas9 蛋白。其次,ACRllC3 并没有直接结合到 Cas9 的反应位点上,而是把两个 Cas9 拉到一起,大幅度改变了 Cas9 的结构,让它失去了与 DNA 结合的能力。
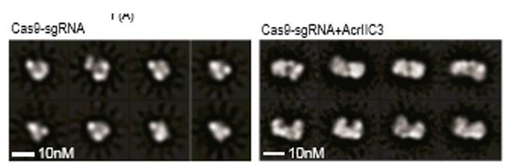
图丨在电子显微镜下,可以清楚地看到,在加入 ACRIIC3 前(左图),Cas9 单个存在。加入 ACRII3 后(右图),两个 Cas9 结合到了一起。
和之前的研究相比,Doudna 和她的同事在《细胞》上发表的最新论文更透彻地研究了抑制基因编辑的机理。他们不仅通过生物化学的方法确认了抑制活性,还通过结构生物学的方法掌握了 ACR 蛋白质克制 Cas9 的原因。
而到现在为止,我们还没有方法可以终止基因编辑的过程。一旦基因编辑的流程启动,就只能等待整个过程自然结束,就好像一辆只有油门,没有刹车的汽车。之前有研究表明,CRISPR-Cas9 可以击中准确目标的基因编辑中,有大约一半发生在编辑过程开始的 6 小时内。而在 6 小时后,脱靶的编辑开始变多。
布罗德研究所的生物科学家 Dane Hazelbaker 曾表示,利用 Cas9 进行基因片段切割非常容易,但重要的是要能控制它。如果把 Cas9 比作一位外科医生,他擅长的是阑尾炎切除术。但如果你想只是切除阑尾,而不损伤旁边的胆囊,你就需要 ACR 这样的 Cas9 酶活抑制剂。它就像“能在手术剪刀剪向重要器官之前,狠狠拽开拿着剪刀的双手。”
现在,科研人员认为他们已经发现了这双可以“拽开剪刀的双手”。之前有研究表明,即使在 6 个小时后添加 Cas9 抑制剂,也能把脱靶效应降低一半。当时参与这项研究的加州大学旧金山分校的 Joseph Bondy-Denomy 就表示,Cas9 抑制剂可以在基因编辑完成之后,准确地定时关闭 Cas9 产生,而不会让 Cas9 在细胞中停留而冒险产生脱靶效应。
除了让时间窗口变得更精确,Cas9 抑制剂还可以让 CRISPR-Cas9 系统的针对性更强。研究人员有可能在未来将 Cas9 的抑制蛋白加入基因编辑系统里,让我们能针对某个特定的器官、组织、发育阶段的的细胞进行基因编辑。
值得注意的是,Doudna 等人还发现,整个 ACR 家族的抑制范围,比之前想的可能要广泛得多。这些蛋白不仅有可能抑制可以切割双链 DNA 的 Cas9,甚至还有可能针对切割单链 DNA 的限制性内切酶。
作者在论文的讨论部分也表示,随着基因编辑工具的增加,像 Arc 这样广谱的控制工具也变得越来越重要。持续研究不同的 ACR 蛋白的机理,将提供一个独一无二的机会,让我们更好地对基因编辑进行控制。(来源:生物 360)
A Broad-Spectrum Inhibitor of CRISPR-Cas9
Abstract CRISPR-Cas9 proteins function within bacterial immune systems to target and destroy invasive DNA and have been harnessed as a robust technology for genome editing. Small bacteriophage-encoded anti-CRISPR proteins (Acrs) can inactivate Cas9, providing an efficient off switch for Cas9-based applications. Here, we show that two Acrs, AcrIIC1 and AcrIIC3, inhibit Cas9 by distinct strategies. AcrIIC1 is a broad-spectrum Cas9 inhibitor that prevents DNA cutting by multiple divergent Cas9 orthologs through direct binding to the conserved HNH catalytic domain of Cas9. A crystal structure of an AcrIIC1-Cas9 HNH domain complex shows how AcrIIC1 traps Cas9 in a DNA-bound but catalytically inactive state. By contrast, AcrIIC3 blocks activity of a single Cas9 ortholog and induces Cas9 dimerization while preventing binding to the target DNA. These two orthogonal mechanisms allow for separate control of Cas9 target binding and cleavage and suggest applications to allow DNA binding while preventing DNA cutting by Cas9.
原文链接:http://www.sciencedirect.com/science/article/pii/S0092867417308735

