上海药物所化学蛋白质组学中心赖氨酸琥珀酰修饰取得新进展
蛋白翻译后修饰对蛋白的结构和功能起着非常重要的调节作用,赖氨酸琥珀酰化是上海药物所和芝加哥大学共同合作在原核和真核细胞中最新发现的蛋白翻译后修饰通路。研究团队开创性地对哺乳动物细胞中的去乙酰化修饰酶Sirt5调控的琥珀酰化修饰底物进行了系统的蛋白质组学研究,发现了琥珀酰化修饰对能量代谢中的关键酶的调控作用,文章相继发表在Nature Chemical Biology和Molecular Cell上。但在原核生物中,控制该修饰的琥珀酰化底物及调节酶仍然未知,成为该修饰在原核生物研究的障碍。
上海药物所化学蛋白质组学中心和芝加哥大学通过进一步合作,系统研究了大肠杆菌中的琥珀酰化修饰底物,并发现了该修饰的调节酶CobB。此次研究在大肠杆菌中发现了670个蛋白上的2580个赖氨酸琥珀酰修饰位点,是原核生物中赖氨酸琥珀酰修饰研究的第一批数据资料。同时还在782个蛋白中找到了2803个乙酰化修饰位点,获得了野生型大肠杆菌中最大的赖氨酸乙酰化修饰数据库。
此项研究首次通过定性定量分析揭示了高糖营养环境的赖氨酸琥珀酰动态变化网络,表明高糖环境可以导致琥珀酰化和乙酰化修饰的显著增加,并对琥珀酰化修饰的影响更大,揭示了赖氨酸琥珀酰化在原核生物中为一高丰度修饰。研究还首次发现了原核生物中的去琥珀酰修饰酶-CobB(类Sir2细菌赖氨酸去乙酰化酶),表明该酶具有赖氨酸去琥珀酰化和去乙酰化双重功能活性,提示其他乙酰化调节酶也可能有多种酶活性。此次研究为原核生物中赖氨酸琥珀酰化和乙酰化功能性研究提供了丰富的资源。
上海药物所相关研究工作以共同通讯作者单位发表在最新一期Molecular. Cell. Proteomics(IF 7.398)杂志上。(药物所)
文章链接:http://www.mcponline.org/content/12/12/3509.abstract
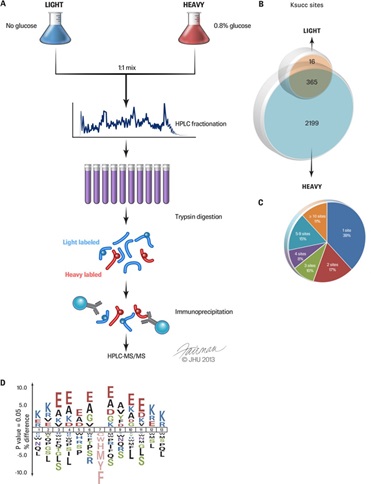
大肠杆菌赖氨酸琥珀酰修饰的定量蛋白组学分析

