生命中心李海涛研究组合作开发三维卡宾SPR成像微阵列技术进行高通量表观遗...
生命中心李海涛研究组和中科院纳米中心朱劲松研究组合作发文
开发三维卡宾SPR成像微阵列技术进行高通量表观遗传互作筛选
8月14日,生命中心李海涛研究组和中科院国家纳米科学中心朱劲松研究组合作于《美国科学院院刊》(PNAS)在线发表题为“Kinetic and high-throughput profiling of epigenetic interactions by 3D-carbene chip-based surface plasmon resonance imaging technology”(基于三维卡宾芯片的表面等离子体共振成像技术动态高通量检测表观遗传互作)的研究论文,报道了基于三维表面和卡宾化学的表面等离子体共振成像(SPRi)微阵列技术在检测生物分子互作尤其是修饰依赖互作中的应用。
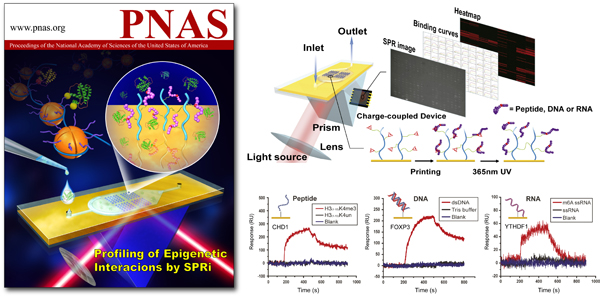
图1:利用三维卡宾芯片SPRi技术筛选表观遗传互作
(Zhao et al, http://www.pnas.org/cgi/doi/10.1073/pnas.1704155114)
生物分子间相互作用,尤其是基于动态修饰的生物分子间识别互作,是生命活动在分子层面的具体体现,也是生命调控的重要生化分子基础。因此,发现和鉴定生物分子互作对在一定意义上是了解信号转导、基因调控、以及功能复合物形成的基础和前提。目前,鉴定生物分子互作的生化或生物物理手段主要包括免疫共沉淀(Co-IP)、亲和标签拉下(pull-down)、凝胶迁移(EMSA)、热迁移(TSA)、等温滴定量热(ITC)、核磁滴定(NMR titration)、表面等离子体共振(SPR)、生物膜层干涉(BLI)、荧光偏振(FPA)、荧光共振能量转移( FRET )、微量热泳动(MST)、以及基于荧光的微阵列芯片技术等。其中以ITC为代表的互作手段可以定量检测相互作用,但检测的通量往往不高,而且样品消耗量大;而荧光芯片等技术虽然有着极高的检测通量,很少的样品消耗量,但定量检测较为困难。因此,开发并优化生物分子互作的高通量、高灵敏度、定量检测技术对于深入理解生命活动及其调控的生化分子基础有着重要意义。
李海涛教授长期致力于新型表观遗传互作对的发现及其分子识别机制研究,先后发现并阐明了包括YEATS、PHD锌指等在内的一系列“阅读器”(reader)结构域识别组蛋白酰基化、甲基化等修饰的分子基础和调控机制。值得一提的是,在上述组蛋白“修饰-阅读器”互作对的发现过程中,德克萨斯大学石晓冰教授开发的基于荧光的修饰多肽阵列芯片发挥了重要推动性作用;近期,李海涛研究组与德克萨斯大学Mark Bedford教授合作在《自然化学生物学》(Nat Chem Biol)发文,利用蛋白阵列芯片研发特定“阅读器”靶向的小分子抑制剂。上述工作均突出了“lab-on-chip”微阵列技术在表观遗传互作发现中的重要作用。国家纳米科学中心朱劲松研究员长期从事三维表面化学和SPRi微阵列技术的开发。其中表面等离子体共振(SPR)技术主要通过测量分子结合导致芯片表面折射率变化来检测多种生物分子的结合过程。传统的SPR生物传感器采用线性CCD直接测量芯片表面共振角的变化,只能进行少数几个位点的检测。而SPRi技术将传统的SPR技术与成像技术相结合,采用二维CCD对芯片表面进行摄影,通过对影像明暗变化的检测,平行计算出多个位点的折射率的变化,从而实现生物分子互作信息的高通量捕获。在《美国科学院院刊》发表的长文中,李海涛研究组同朱劲松研究组紧密合作,利用卡宾化学随机交联生物分子、三维表面高信噪比和低位阻效应、以及SPRi实时动态平行监测等特性,实现了高通量定量检测生物分子相互作用。
研究人员首先通过一系列表面化学优化成功在一张SPRi芯片上实现了包括多肽、蛋白(抗体)、DNA和RNA在内的多种类型生物分子的打印固定和微阵列制备(集成度可达数百至上千个点/芯片,样品消耗仅1-10pmol/阵点)。由于卡宾自由基十分活跃,可以插入到生物分子中普遍存在的C-H键中,进而实现生物分子的高度随机交联固定。这一策略一方面可以实现生物分子的非标记固定,免除了诸如生物素标记等额外环节,并降低了成本;另一方面交联的高度随机性也最大程度保证了被固定分子的全频谱取向和功能保留,避免了定点固定可能导致的结合假阴性。此外,交联所采用的三维芯片表面,相比于普通二维表面大大提高了固定容量并降低影响结合的空间位阻效应,提高了信噪比。在此基础上,利用PlexArray HT SPRi分子互作检测仪,研究人员实现了针对芯片内容的实时动态无标记结合检测。数据表明,该体系对于多肽-蛋白互作,抗体-抗原互作,双链DNA-蛋白互作, 单链RNA-蛋白互作均有效。值得一提的是,该方法成功检测出了RNA甲基化“阅读器”YTHDF1对m6A修饰RNA的特异识别,表明了本技术在新兴的核酸修饰识别因子发现方面的潜力。随后,研究人员通过固定125种修饰组蛋白多肽连续检测8种已知组蛋白阅读器,基于三维卡宾芯片的SPRi技术可以快速实现对1000对相互作用的高通量动力学检测,筛选结果与领域报导高度一致。通过该技术平台,研究人员发现人源转录元件TAF3的PHD锌指结构域可以同组蛋白H3赖氨酸4乙酰化(H3K4ac)发生亚毫摩尔级的弱结合;以及荠菜中DNA损伤修复因子MSH6的氨基端Tudor结构域可以同组蛋白H3赖氨酸4三甲基化(H3K4me3)发生微摩尔级强结合。随后的等温滴定量热或复合物晶体结构解析验证了上述发现,进一步证实了基于三维卡宾芯片的SPRi平台在检测弱相互作用及发现新型表观遗传互作对方面的能力。
本工作由李海涛研究组和中科院国家纳米科学中心朱劲松研究组联合完成。李海涛研究组博士生赵帅和朱劲松研究组博士生杨墨为本论文共同第一作者,博士生周文菲,张柏超,黄嘉欣,张敏,王瑞及程志强博士,汪之又博士,陈忠磊博士参与了本项研究。本项目得到科技部重点研发计划,国家自然科学基金、生命科学联合中心、北京市结构生物学高精尖创新中心(清华)等资助。仪器设备使用得到“凤凰工程”蛋白质基础设施(清华)支持,衍射数据收集得到上海同步辐射光源BL17U1线站的大力支持与协助。


